
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон возрастания энтропии
|
|
|
|
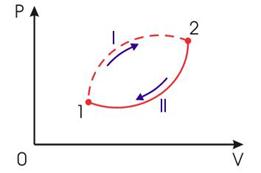
Рис.2.
Необратимый круговой термодинамический процесс
Применим неравенство (3) для описания необратимого кругового термодинамического процесса, изображенного на рис 2.
Пусть процесс 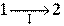 будет необратимым, а процесс
будет необратимым, а процесс  - обратимым. Тогда неравенство (3) для этого случая примет вид:
- обратимым. Тогда неравенство (3) для этого случая примет вид:
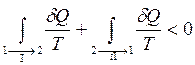 (4)
(4)
Так как процесс  является обратимым, для него можно воспользоваться соотношением (2), которое дает:
является обратимым, для него можно воспользоваться соотношением (2), которое дает:
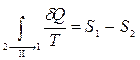 (5)
(5)
Подстановка этой формулы в неравенство (4) позволяет получить выражение:
 (6)
(6)
Сравнение выражений (2) и (6) позволяет записать следующее неравенство:
 (7)
(7)
в котором знак равенства имеет место в случае, если процесс 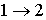 является обратимым, а знак больше, если процесс
является обратимым, а знак больше, если процесс  – необратимый.
– необратимый.
Неравенство (7) может быть также записано и в дифференциальной форме:
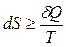 (8)
(8)
Если рассмотреть адиабатически изолированную термодинамическую систему, для которой 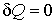 , то выражение (8) примет вид: Δ S = S 2 – S 1 ≥ 0
, то выражение (8) примет вид: Δ S = S 2 – S 1 ≥ 0
или в интегральной форме:
/d S ≥ 0 (9)
Из формулы (9) следует: S 2 ≥ S 1.
Полученные неравенства выражают собой закон возрастания энтропии, который можно сформулировать следующим образом:
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Записанное утверждение является ещё одной формулировкой второго начала термодинамики.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.
Термодинамическому равновесию адиабатической системы соответствует состояние с максимумом энтропии. Энтропия может иметь не один, а несколько максимумов, при этом система будет иметь несколько состояний равновесия. Равновесие, которому соответствует наибольший максимум энтропии называется абсолютно устойчивым (стабильным). Из условия максимальности энтропии адиабатические системы в состоянии равновесия вытекает важное следствие: температура всех частей системы в состоянии равновесия одинакова.
Рост энтропии является общим свойством всех самопроизвольно протекающих необратимых процессов в изолированных термодинамических системах. В состоянии равновесия энтропия принимает максимальное значение. В состоянии с максимальной энтропией макроскопические необратимые процессы невозможны.
При обратимых процессах в изолированных системах энтропия не изменяется.
Необходимо отметить, что если система не является изолированной, то в ней возможно уменьшение энтропии. Примером такой системы может служить, например, обычный холодильник, внутри которого возможно уменьшение энтропии. Но для таких открытых систем это локальное понижение энтропии всегда компенсируется возрастанием энтропии в окружающей среде, которое превосходит локальное ее уменьшение.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 553; Нарушение авторских прав?; Мы поможем в написании вашей работы!