
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы генетики 1 страница
|
|
|
|
БИОЛОГИЧЕСКИЕ АСПЕКТЫ КЛИНИЧЕСКОЙ МЕДИЦИНЫ
РАЗДЕЛ 1. ГЕНЕТИКА И БОЛЕЗНИ ЧЕЛОВЕКА
ГЛАВА 57. ГЕНЕТИЧЕСКИЕ АСПЕКТЫ БОЛЕЗНИ
Джозеф Л. Голдстейн, Майкл С. Браун (Joseph L. Goldstein, Michael S. Brown)
Более одной пятой всех белков (а следовательно, и генов), содержащихся в организме каждого человека, существует в форме, различающейся у большинства членов популяции. Эта замечательная генетическая вариабельность, или полиморфизм, и обеспечивает многообразие особенностей человеческого организма, таких, как рост, умственные способности, давление крови и т. д. Генетические различия также определяют способность каждого индивидуума реагировать на неблагоприятные внешние воздействия, в том числе и на болезнетворные. Все болезни человека можно рассматривать как результаты взаимодействия его индивидуальной генетической структуры с окружающей средой. При некоторых заболеваниях этот генетический компонент отчетливо проявляется и без чрезвычайных внешних воздействий. Такие заболевания носят название генетических.
Молекулярная основа экспрессии гена. Вся наследственная информация передается от родителей к детям посредством наследования дезоксирибонуклеиновой кислоты (ДНК). ДНК—это линейный полимер, состоящий из пуриновых и пиримидиновых оснований, последовательность которых полностью предопределяет последовательность аминокислот любого белка, синтезируемого организмом. Четыре типа оснований ДНК организованы в группы по три; каждый триплет образует кодовое слово, или кодон, которое кодирует конкретную аминокислоту. Ген представляет собой общую последовательность оснований в ДНК, определяющую последовательность аминокислот в полипептидной цепи одиночной молекулы белка.
Генетическая информация, закодированная в ДНК хромосом, вначале транскрибируется (переписывается)-на копию из рибонуклеиновой кислоты (РНК). Во время транскрипции рибонуклеотиды выстраиваются вдоль ДНК согласно правилам комплементарности оснований. Так, аденин ДНК образует пару с уридином РНК, цитозин — с гуанином, тимин — с аденином, а гуанин — с цитозином. Рибозные основания соединяются вместе посредством РНК-полимеразы. Полученный в результате РНК-транскрипт образует матрицу для трансляции в последовательность аминокислот белка. На рис. 57-1 приводятся кодовые слова ДНК и РНК для каждой аминокислоты белка.
Таким образом можно создавать информативные мутантные фенотипы и сразу же клонировать интересующий ген. Клонированные последовательности можно использовать для поиска последовательностей мРНК, а по ним определять сайты тканеспецифической экспрессии и временные характеристики экспрессии гена. Если данный участок кодирует белок, то по последовательностям нуклеиновых кислот можно определить структуру пептидов, которые затем можно синтезировать и использовать для наработки антител, с помощью которых можно было бы определить тканеспецифическое и клеточноспецифическое размещение этого белка. Например, метод вставочного мутагенеза был использован для идентификации летальной эмбриональной мутации в гене коллагена типа I у мыши. Перечисленные средства позволяют создавать информативные фенотипы, исследовать молекулярную основу фенотипа и делать, заключения о соответствующей нормальной биологии и физиологии.
Наличие подробных генных карт человека значительно упрощает поиски генетических вариаций, ассоциированных с предрасположенностью к заболеванию. Тот факт, что многие известные болезни ассоциируются с HLA-локусом, может объясняться либо тем, что гены предрасположенности к заболеваниям локализуются преимущественно в этой области, либо тем, что для высокополиморфных маркеров проще получать данные. По мере картирования посредством ПДРФ других частей генома могут проявиться дополнительные ассоциации между заболеваниями и генетическими маркерами. Такие ассоциации будут способствовать идентификации тех генов, вариации которых предрасполагают к полигенцым или многофакторным заболеваниям.
Этические соображения. В настоящее время пренатальную диагностику осуществляют при болезнях различной степени тяжести, таких как дефицит сц-антитрипсина, фенилкетонурия, серповидно-клеточная анемия, мышечная дистрофия и семейная гиперхолестерннемия. В вопросе о допустимости искусственного прерывания беременности по поводу этих заболеваний мнения общественности и отдельных лиц разделились. Развитие ген-замещающей терапии и других методов лечения неизлечимых ныне генетических заболеваний может выразиться в конечном итоге и в снижении частоты абортов.
Возможности ген-замещающей терапии затрагивают и другие этические проблемы. Соматическая ген-замещающая терапия связана с индивидуальной оценкой соотношения «риск—польза» для каждого больного. До тех пор пока не затрагивается ДНК половых клеток, людей обычно интересует лишь один серьезный этический вой-рос: наилучшим ли образом соответствует данный метод лечения интересам пациента? Опыт химиотерапии рака позволяет предполагать, что небольшой уровень ненамеренных повреждений ДНК половых клеток воспринимается как нежелательный, но оправданный риск такой терапии, если. она приносит больному существенную пользу. Можно представить, что в будущем методы сайт-специфической рекомбинации позволят замещать мутантную ДНК в половых клетках нормальным материалом. Если кто-то раз и навсегда сможет корректировать в половых клетках человека мутации, приводящие к кистозному фиброзу, хорее Гентингтона или серповидно-клеточной анемии, и если лечение будет эффективным и безопасным, то будет ли общество рассматривать такую терапию как грубое вмешательство?
Список литературы
Antonarakis S. E. et. al. DNA polymorphism and molecular pathology of the
human globin gene clusters. — Hum. Genet., 1985, 69, 1. Beaudet A. L. Bibliogeaphy of cloned human and other selected DNAs. — Am. J.
Hum. Genet., 1985, 37, 386. Boistein D. et. al. Construction of a genetic linkage map. in man using restriction
fragment length polymorphisms. — Am. J. Hum. Genet., 1980, 32, 314. Gill P. et al. Forensic application of DNA,,Fingerprints". — Nature, 1985, 318, 577. Gusella J. F. et al. DNA markers for nrvous system diseases. — Science, 1984,
225, 1320. Lawn R., M. et al. The molecular genetics of hemophilia: Blood clotting factors
VIII and IX.--Cell, 1985, 42, 405.
Monaco A. P. et al. Detection of deletions spanning the Diichenne muscular dystrophy locus using a tightly linked DNA segment. — Nature, 1985, 316, 842. Ncwmark P. Testing for cystic fibrosis. — Nature, 1985, 318, 309. Reedcrs S. Т. et al, A highly polymorphic DNA marker linked to adult polycystic
kidney disease on chromosome 16. -- Nature, 1985, 317, 542. Watson.1. D. et al, Recom!)inant DNA. A Short Course.--Scientific American
Books. Distributed by W. A. Freeman. Co., New York, 1983. Williams D. A. et ai. Introduction of new genetic material into pluripotent haematopoietic stem cells of the mouse.—. Nature, 1984, 310, 476.
ГЛАВА 59. ОНКОГЕНЫ И НЕОПЛАСТИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Поль Нейман (Paul Neiman)
При делении раковые клетки передают дочерним клеткам неопластический фенотип. Но этой причине получило всеобщее распространение мнение о том, что наследование неопластического фенотипа предопределяется специфическими генами. Это предположение объясняет чрезвычайный интерес исследователей-онкологов к онкогенным вирусам. Несмотря на сравнительную генетическую простоту, они вызывают все патологические и клинические изменения, ассоциированные с неопластическим заболеванием, и в некоторых случаях вирус способен вводить в нормальную клетку единственный ген (онкоген), продукт которого инициирует и поддерживает неопластическое состояние. Онкогены представляют собой измененные формы клеточных протоонкогенов, которые в норме выполняют в клетке важные функции. Человеческие гомологи некоторых из этих онкогенов могут играть определенную роль в раковых заболеваниях человека. Эта ситуация поднимает ряд вопросов относительно природы онкогенов, управления их экспрессией, биохимической природы их генных продуктов и механизмов взаимодействия с метаболизмом клетки-хозяина.
Ретровирусные онкогены. Взаимодействие ретровирусов с клеткой-хозяином. Открытие онкогенов явилось результатом изучения молекулярной биологии РНК опухолевых вирусов (ретровирусов). Ретро-вирусы широко распространены в природе и инфицирование некоторыми из них ассоциируется с новообразованиями у животных; другие же опухолегенными свойствами не обладают. Геном ретровируса представляет собой молекулу РНК длиной от 8000 до 10000 нуклеотидов. Отличительной особенностью жизненного цикла ретровирусов является то обстоятельство, что после проникновения вируса в клетку геномная молекула РНК копируется на ДНК (обратная транскрипция), и ДНК-копия интегрируется с хромосомной ДНК клетки-хозяина (отсюда и название ретровирус) (рис. 59-1). Эта интегрированная ДНК называется провирусом. Структура типичных провирусов схематически изображена на рис. 59-2. Длинные терминальные повторы (ДТП) содержат последовательности, скопированные с обоих концов геномной РНК вируса, размещены на каждом конце ДНК провируса н сцеплены непосредственно с ДНК хозяина. ДТП содержат последовательности, регулирующие экспрессию генов при репликации вирусов: gag кодирует внутренние структурные белки, pol— обратную транскрнптазу, env — гликопротеин вирусной оболочки. В регуляторные последовательности включены сигналы инициации и терминации транскрипции. Обычно они содержат также могучий ген-усилитель, способный настолько повысить темп транскрипции вирусных генов, что провирусный РНК-транскрипт будет составлять от 0,1 до 1% полного клеточного содержания мРНК. Промоторы и усилители транскрипции обычно включаются лишь в клетках определенного типа, чем и определяется тканеспецифичность вирусных генов. В других случаях активность последовательностей-усилителей реализуется стероидными гормонами. В отличие от многих других вирусов ретровирусы обычно не приводят клетку-хозяина к гибели после завершения репликации; вместо этого они встраиваются в экзогены, вызывают их экспрессию и тем самым меняют фенотип клетки-хозяина.
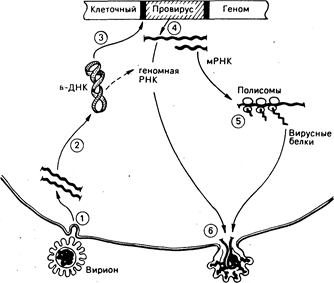
Рис. 59-1. Репликация ретровирусов.
(1) Оболочечный гликопротеин на поверхности вирусных частиц (вирионов) опознает рецепторы, способствующие входу в клетку, и освобождает вирусную геномную РНК.
(2) Каждый вирион содержит две молекулы вирусной РНК, которые в клетке копируются обратной транскриптазой в циклические скрученные молекулы вирусной ДНК.
(3) Некоторые из циклических молекул ДНК встраиваются в хромосомную ДНК хозяина в строго определенных точках молекулы вирусной ДНК и в случайном, или почти случайном, сайте хромосомы хозяина. (4) Интегрированная копия вирусной ДНК, или провирус, транскрибируе-тся как в мРНК, которая транслируется на клеточных полисомах в вирусные белки (5), так и в полимерную геномную вирусную РНК, которая содержит специфические последовательности, служащие сигналами упаковки при сборке вируса. (6) Вирусные РНК и белки собираются в частицы, которые затем покидают клетку. Весь процесс может не сопровождаться цитопатическими эффектами для клетки хозяина.
Остротрансформирующие ретровирусы и их онкогены. Заражение животных ретровирусами, содержащими только гены gag, pol и env, сопровождается новообразованиями лишь после долгого латентного периода. Напротив, остротрансформирующие ретровирусы в считанные дни или недели могут вызвать неоплазию in vivo или привести к перерождению клеток в культуре in vitro. Прототипом этого класса вирусов служит вирус саркомы Рауса. Структура провирусов из этих двух классов онкогенных агентов приведена на рис. 59-2. Почти все известные остротрансформирующие ретровирусы дефективны, т. е. они утратили часть генов, необходимых для репликации, и, следовательно, их распространение возможно лишь путем коинфекции со стандартными ретровирусами-хелперами. Такие дефекты являются результатом замещения репликативных генов вируса на онкоген, который играет роль посредника для. непосредственно трансформирующих свойств вируса. Исключения из этого общего правила представлены некоторыми штаммами вируса саркомы Рауса, которые имеют как репликативные гены, так и онкогены. Хотя конкретный сегмент вирусного генома, который замещается на онкоген, может варьировать, общая конфигурация остротрансформирующих вирусов такова, как это показано на рис. 59-2. В этом случае онкоген спаян с 5`-областью вирусного гена gag, в результате чего синтезируется трансформирующий белок с пептидами gag в аминотерминале.
В табл. 59-1 приводится список некоторых вирусов онкогенов, их природных хозяев и типов опухолей, которые они вызывают. В случае вируса саркомы Рауса роль гена src в неопластических трансформациях была установлена средствами генетики и биохимии. Известны мутации, вызывающие обратимую инактивацию продуктов гена src при повышении температуры (так называемые температурочувствительные мутации). Эти мутации переводят трансформированный фенотип в нормальное состояние, если инфицированные клетки подвергаются воздействию повышенной температуры. При понижении температуры клетки снова возвращаются в трансформированное состояние. Аналогичные, хотя и не столь полные, данные получены и для других вирусов, перечисленных в табл. 59-1.

Рис. 59-2. Сравнительные структуры провирусов со стандартной компетентной репликацией и остро трансформирующих ретровирусов. В обоих случаях провирус окаймлен прямыми последовательностями длинных терминальных повторов (ДТП), которые содержат основные элементы регуляции: включая промоторы и усилители транскрипции, сигналы терминации транскриптов вирусной РНК (сигналы добавки поли-А) и сигналы интеграции в ДНК хозяина. Между ДТП стандартного ретровируса находятся три гена: gag (внутренние структурные белки), pol (обратная транскриптаза) и env (гликопротеин оболочки), которые необходимы для инфекции и репликации. У остротрансформирующих вирусов все или часть репликативных генов замещены трансформирующим онкогеном, который и определяет онкогенные свойства вируса. Наиболее общей структурой является спайка 5'-участка гена gag с онкогеном. Стандартный провирус транскрибируется в полномерную вирусную РНК и в мРНК для синтеза вирусных белков. Остротрансформирующий провирус часто экспрессирует только один сайт РНК-транскрипта. В этом случае репликация дефективна и для размножения требуется коинфекция со стандартным ретровирусным «хелпером». Символ Agag означает, что часть последовательности gag исчезла в результате делеции.
Почти все трансформирующие вирусы могут быть обнаружены in vitro по их способности вызывать перерождение клеток в культуре. Стандартный тест состоит в формировании инфицированными фибробластами (или линиями фибробластоподобных клеток) морфологически измененных клеток. Некоторые из порождающих лейкемию вирусов могут трансформировать макрофаги и/или кроветворные клетки in vitro.
Протоонкогены. Онкогены ретровирусов находятся в близком родстве с нормальными генами клеток. Это родство было установлено в результате открытия гомологичности в нуклеотидных последовательностях трансформирующего онкогена вируса саркомы Рауса v-src (вирусного src) и нормального гена цыпленка с-сгс (клеточного src). Очевидно, вирус саркомы Рауса явился результатом рекомбинаций между c-src и древним стандартным ретровирусом птиц. Такой механизм — рекомбинация между вирусным геном и геном хозяина — служит очевидным объяснением образования трансформирующих вирусов (см. табл. 59-1). По этой причине функции нормальных генов и их роль в невирусных новообразованиях вызывают повышенный интерес исследователей.
В природе нормальные формы онкогенов весьма консервативны. Для каждого из них существуют человеческие гомологи, а гомологи некоторых из них присутствуют во всех эукариотических организмах, до беспозвоночных и дрожжей включительно. Такой консерватизм наводит на мысль, что эти гены выполняют в нормальных клетках жизненно важные функции, и предполагает, что онкогенный потенциал приобретается генами только после функционально значимых изменений (таких, например, какие происходят при рекомбинации с ретровирусом). О таких генах говорят как о протоонкогенах (с-оnс).
Таблица 59-1. Вирусные онкогены, вызывающие острые трансформации
| Название | Вирус | Опухоли in vivo |
| Цыплята | ||
| Src | Вирус саркомы Рауса | Саркомы |
| Yes | Вирус саркомы Y73 | Саркомы |
| fps/fes | Вирус саркомы Fujinami | Саркомы |
| Ros | Вирус птичьей саркомы UR11 | Саркомы |
| erb/B | Вирус птичьего эритробластоза (AEV) | Эритроидный лейкоз |
| Myb | Вирус птичьего миелобластоза. (AMV) | Миелоидный лейкоз |
| my с | Вирус птичьего миелоцитоза (МС-29) | Лейкоз, эндотелиом а |
| Sci | Птичий вирус SKV/770 | Неизвестно |
| Индюки | ||
| rei | Вирус ретикулоэндотелиоза (REV) | Лимфомы |
| Мыши | ||
| abl | Вирус лейкоза Abelson | В-л и мфо мы |
| nios | Вирус мышиной саркомы | Саркомы |
| Молони (MoMSV) | ||
| fos | Вирус остеосаркомы FBj | Остеосаркома |
| raf | Вирус мышиной саркомы 3611 | Саркомы |
| Крысы | ||
| Ha-ras-1 | Вирус мышиной саркомы | Саркомы, эритроид- |
| Гарвея (HaMSV) | ный лейкоз | |
| Ki-ras-2 | Вирус мышиной саркомы | Саркомы, эритроид- |
| Кирстена (KiMSV) | ный лейкоз | |
| Кошки | ||
| fes/fps | Вирус кошачьей саркомы | Саркомы |
| Snyder Thieien ST-FeSV | ||
| fins | Вирус кошачьей саркомы | Саркомы |
| McDonough (SM-FeSV) | ||
| I'gr | Вирус кошачьей саркомы | Саркомы |
| Gardner Rasheeds (GR-teSV) | ||
| Обезьяны | ||
| sis | Вирус обезьяньей саркомы | Саркомы |
| (SSV) |
Нуклеотидные последовательности белков кодирующих областей вирусных онкогенов отличаются от таковых для протоонкогенов. Существуют также принципиальные различия в регуляции экспрессии вирусных и клеточных генов. Например, нормальные клеточные формы онкогена могут экспрессироваться без трансформации клетки, хотя обычно экспрессия протекает на более низком уровне, и/или с более жесткой регуляцией, чем.для вирусных онкогенов, экспрессируемых провирусами. Относительные вклады сверхэкспрессии, измененной регуляции и структурных мутаций в трансформирующую активность вирусных онкогенов не вполне ясны. Все эти элементы могут обладать той или иной степенью важности в зависимости от конкретного онкогена и типа клетки-мишени.
Инфицирование ретровирусами, не содержащими онкогенов, может вызвать новообразования у некоторых животных, но после долгого латентного периода. Общим механизмом такой онкогенной активности является активация клеточных протоонкогенов, на что указывает образование лимфом в фабрициевой сумке цыплят, зараженных вирусом лейкоза птиц (ВЛП). При этих новообразованиях протоонкоген, называемый с-тус, экспрессируется с высоким уровнем в результате интеграции промотора-усилителя ВЛП-генома вблизи с-mус. Тот факт, что эти опухоли клонируются и активация с-тус наблюдается только в опухолевых клетках, вкупе с известным онкогенным потенциалом v-myc подтверждает идею- о том, что с-тус играет важную роль в образовании этих опухолей. В табл. 59-2 приведен список протоонкогенов, о которых известно, что они активируются в порождаемых ретровирусом опухолях с большим латентным периодом. Некоторые из-них (myc, erb В) гомологичны известным вирусным онкогенам. Другие (Int-1, Int-2, Pim-1, Mlvi-1, Mlvi-2) не идентифицированы как части геномов остротрансформирующих вирусов. Их онкогенный потенциал выводится по аллелям.
Таблица 59-2. Протоонкогены и предполагаемые протоонкогены, активирующиеся в опухолях путем интеграции с ретровирусными провирусами
| 'In кvr- или t'l! MIl'ni'Hb | Вирус | Опухоль |
| е-in ус | Вирус птичьего лейкоза | Лимфомы В-клеток (цыплята) |
| .'-туе | Вирус кошачьего лейкоза | Лимфомы (кошки) |
| с-ту с | Вирус мышиного AKR-лейкоза | Лимфомы Т-клеток (мыши) |
| .•-erb В | Вирус птичьего лейкоза | Эритроидный лейкоз (цыплята) |
| ^пп-1 | Вирус мышиного AKR-лейкоза | Лимфома Т-клеток (мыши) |
| Vlbvi-1 | Вирус мышиного лейкоза Молони | Лимфома Т-клеток (крысы) |
| Vlbvi-2 | Вирус мышиного лейкоза Молони | Лимфома Т-клеток (крысы) |
| iit-1 | Вирус опухоли молочной железы мыши | Аденокарцинома молочной железы (мыши) |
| nt-2 | Вирус опухоли молочной железы мыши | Аденокарцинома молочной железы мыши |
Ретровирусы человека. Вирусы лейкоза Т-клеток человека (HTLV) являются ретровирусами, реплицирующимися преимущественно в лимфоцитах человека. Инфицирование HTLV типа I ассоциировано с развитием специфического типа лейкемии Т-клеток у взрослых, которая с нарастающей частотой встречается в южной Японии и странах Карибского бассейна. Инфицирование in vitro штаммом HTLV-I культуры Т-клеток человека подтверждает способность вызывать рост независимо от экзогенных факторов роста Т-клеток (иммортализация). Инфицирование другим вирусом, называемым HTLV-III, ассоциируется с синдромом приобретенного иммунодефицита. То же самое справедливо для вируса LAV, ранее ассоциированного с лимфаденопатией. По-видимому, HTLV не содержат клеточно-зависимых онкогенов. Вместо этого они меняют поведение клетки-хозяина уникально взаимодействующими вирусными регуляторными белками.
Нормальная человеческая ДНК содержит структуры, которые могут оказаться провирусами и генетически передаются половыми клетками. Значимость таких структур неизвестна.
Активированные клеточные онкогены, детектируемые трансфекцией. Трансфекционный тест на онкогены. Некоторые из известных клеточных линий обладают способностью инкорпорировать экзогенную ДНК в свой хромосомный аппарат с такой эффективностью, что появляется возможность экспериментального введения гена (трансфекции) непосредственно в культуру тканей. Технология трансфекции обычно заключается в осаждении ДНК на поверхность клеток-мишеней фосфатом кальция с последующим поглощением ДНК внутрь клетки посредством пиноцитоза. Некоторые из поглощенных молекул ДНК транспортируются в клеточное ядро и интегрируются в хромосомную ДНК. Если трансфектированная ДНК содержит ген, который может экспрессироваться в клетке-реципиенте как доминантный селектируемый маркер, то клетки, экснрессирующие этот признак, могут быть обнаружены в культуре с эффективностью до одной клетки на каждые 105 событий трансфекции. Многие из вирусных онкогенов. (см. табл. 59-1) могут вызвать трансформации в тестах описанного типа. Трансформация такого рода имеет место как при использовании чистой онкогенной ДНК, так и при использовании хромосомной ДНК клеток, трансформированных ретровирусами.
Таблица 59-3. Онкогены, обнаруженные в опухолях человека трансфекцией клеток NiH/3ТЗ
| Онкоген | Опухоли или опухолевые линии клеток |
| с-гас" | Линии клеток из, карциномы мочевого пузыря EJ/T24, карциномы легкого и карциносаркомы молочной железы |
| c-racк | Карциномы легкого, толстой кишки, мочевого пузыря, поджелу- |
| гacN | Нейробластома, фибросаркома, промиелоцитарный и острый мие-лоцитарный лейкоз, лимфома Беркитта и карцинома толстой кишки |
| HuBlym-1 | Несколько линий клеток из лимфомы Беркитта |
| Tlym-1 | Линии клеток из Т-клеточной лимфомы' |
Клонированный ген Tlym-1 мышиного происхождения. Судя по паттернам инактивации рестриктазами, аналогичный трансформирующий ген активирован в линиях из Т-клеточных лимфом человека.
С помощью данной технологии можно обнаружить также активированные клеточные онкогены в ДНК опухолей, вирусная природа которых не доказана. Например, трансформирующие гены содержатся в ДНК химически трансформированных клеток животных и в ДНК клеток разнообразных опухолей человека и животных нативного происхождения. Нормальная высокомолекулярная ДНК человека не трансформирует клеток, однако трансформирующие гены можно активировать фрагментацией нормальной клеточной ДНК. Эти результаты подтверждают концепцию об активации протоонкогенов нормального генома при формировании опухоли, но они ничего не говорят о том, является ли активация трансформирующих генов причиной или следствием неопластического фенотипа. Хотя лишь небольшая часть ДНК опухолей человека проявляет трансформирующие свойства при трансфекции, эти наблюдения открывают новые пути исследования молекулярной генетики новообразований человека.
Семейство клеточных онкогенов ras. Некоторые из трансформирующих генов, обнаруженные путем трансфекции клеток с помощью ДНК, взятой из клеток опухолей человека, в настоящее время идентифицированы (табл. 59-3). В основном эти онкогены принадлежат к семейству генов, называемому «гас». Первым был идентифицирован человеческий гомолог онкогена вируса мышиной саркомы Гарвея (см. табл. 59-1), названный с-гасВ, кодирующий белок с мол. массой 21 000, названный р21. Этот онкоген был активирован в линии клеток, выделенных из карциномы мочевого пузыря человека. Уровень экспрессии белка р21 в клетках, Трансформированных вирусом сарком.ы Гарвея, достаточно высок, и высокоуровневая экспрессия с-гасВ, вызываемая в эксперименте сцеплением этого клеточного гена с вирусными регуляторными элементами, достаточна для индуцирования трансформации клеток. Однако в тех линиях клеток опухолей человека, в которых с-rасВ обнаруживается, он не проявляет высокого уровня экспрессии. Вместо этого способность к трансформации клеток определяется, по-видимому, точечными мутациями, которые приводят к подмене аминокислот в 12-й или 61-й аминокислотной позиции белка р21. Таким образом, этот протоонкоген активируется либо изменением регуляции, либо мутациями в структуре белка.
Чаще активирован в человеческих опухолях второй ген семейства гас— человеческий гомолог трансформирующего гена вируса мышиной саркомы Кир-стена, названный с-гас Около 10—20% ДНК из различных новообразований человека содержит ген с-rасВ, трансформирующий клетки при трансфекции (см. табл. 59-3). Белок, кодируемый геном с-rасВ,—это та же самая молекула р21, и его трансформирующая активность связывается со структурной мутацией белка, подобной той, что наблюдается для гена с-rасВ. Эта мутация отсутствует в ДНК, извлеченной из нормальных тканей больных, пораженных карциномами, которые содержат активированный ген с-rасВ; это обстоятельство свидетельствует, что активация является соматическим событием, происходящим в процессе формирования опухоли. И наконец, в других экспериментах с трансфекцией ДНК, извлеченной из некоторых опухолей, трансформация индуцируется третьим членом этого семейства, называемом rasN Активация rasN имеет место в 10—20% случаев острых миелоидных лейкемий человека.
Активация генов ras обычна для некоторых химически индуцированных эпителиальных карцином у грызунов, что предполагает активацию этих генов химическими карциногенами. Однако у человека активированные ras-гены найдены лишь в небольшой части опухолей. Это означает, что в человеческих опухолях имеют место еще не идентифицированные изменения генов ras, либо то, что в процессе развития опухолей вместо изменения генов ras происходит изменение других генов. Ни одна из этих вероятностей не может быть определена посредством стандартных опытов по трансфекции. Возможна и другая альтернатива — активация всех онкогенов может оказаться результатом неопластического состояния, а не его первопричиной. Формального доказательства причинной роли активированных ras-генов в тех опухолях человека, в которых они обнаруживаются, не имеется.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 490; Нарушение авторских прав?; Мы поможем в написании вашей работы!