
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы генетики 2 страница
|
|
|
|
Возможные клеточноспецифические онкогены. В отличие от генов семейства ras, проявляющих активность при новообразованиях многих типов, активация других онкогенов может оказаться специфичной для неопластических состояний клеток определенного типа. Первым из этой группы был идентифицирован ген, названный ChBlym-1. ДНК из лимфом цыплят, индуцированных вирусом птичьего лейкоза, трансформирует клетки при трансфекции, в то время как ДНК из нормальных тканей тех же самых птиц этим свойством не обладает. Ген Ch Blym-1, который, как полагают, отвечает за эту активность, был получен из клеток, трансформированных ДНК, выделенной из клеточных линий лимфомы фабрициевой сумки. Этот ген, по-видимому, не имеет отношения к ras или другим вирусным онкогенам, описанным в 'табл. 59-1. Как и для других онкогенов, нуклеотидные последовательности ChBlym-1 законсервировались в процессе эволюции и постоянно присутствуют в ДНК человека.
Как. и вирусиндуцированные лимфомы цыплят, человеческая лимфома Беркитта состоит из тех же самых В-клеток, находящихся примерно на той же стадии дифференциации. ДНК, извлеченная из клеток большинства линий лимфомы Беркитта, может трансформировать клетки при трансфекции. Это свойство объясняется, по-видимому, активностью гена, называемого HuBlym-1, который на уровне последовательностей ДНК на 50% гомологичен гену ChBlym-1. Таким образом, онкогены Blym активированы в В-клеточных лимфомах как цыплят, так и людей, но в опухолях других типов их не обнаруживают. Поскольку характеристики нормальных гомологов этих трансформирующих генов неизвестны, то неизвестны и молекулярные причины их активации.
Другие В- и Т-клеточные новообразования и аденокарциномы молочной железы содержат трансформирующие гены, которые, похоже, различны для каждого типа опухоли. Например, трансформирующий ген новообразований с промежуточной стадией дифференциации Т-клеток, называемый Tlym-t, отличен от других известных онкогенов.
Онкогены, участвующие в образовании опухолей, вызываемых хромосомными транслокациями и другими перестройками. Третья волна свидетельств об активации, онкогенов в процессе формирования опухоли возникла из анализа цитогенетических изменений в новообразованиях человека. Большинство опухолей человека являются клональными, или олигоклональными, т. е. в популяции составляющих их клеток доминирует потомство одной или нескольких клеток. В определенных новообразованиях доминантные клеточные клоны маркированы существенными хромосомными аномалиями, такими, например, как реципрокные гранслокации между хромосомами 9 и 22 при хроническом миелогенном лейкозе (с образованием филадельфийской хромосомы, Рh') или между хромосомами 8 и 14 в случае лимфомы Беркитта. В настоящее время характеристические неслучайные хромосомные изменения идентифицированы для многих новообразований. Гены, находящиеся в сайте перестроенной ДНК или рядом с ним и являющиеся первопричиной этих цитогенетических изменений, могут играть определенную роль в развитии опухолей. Успехи гибридизации in situ и других методов генетики соматических клеток дали возможность определить приблизительные положения ряда протоонкогенов в хромосомах человека (табл. 59-4). Некоторые из этих генов расположены вблизи точек разрыва хромосом, трансформируемых при определенных опухолях.
Таблица 59-4. Локализация некоторых протоонкогенов в хромосомах человека
| Ген | Хромосома | Суб-локализация в хромосоме или зона' |
| с-тус | q24 | |
| с-аЫ | ||
| c-mos | q22 | |
| c-fes | q24—q25 | |
| c-myb | q22—q24 | |
| c-mil (raf) | р25 | |
| N-ras | cen-^p21 | |
| c-ras" | р14.1 | |
| c-ras" | р 12.05-^ter | |
| c-etc | q23—q24 | |
| c-erbB | pter-^q22 | |
| c-erbA | q21—q22 | |
| HuBlum-1 | p32 | |
| c-fms | q34 | |
| c-fos | q21-^q31 | |
| c-ski | NA | |
| c-sis | qll-^ter | |
| c-src-1 | p34—p36 | |
| c-src-2 | ql2^ter |
q — длинное плечо хромосомы, р — короткое плечо хромосомы, сеn — центромер, ter терминал, NA — неизвестно.
Перестройка локуса с-mус в клетках лимфомы Беркитта. Как показано в табл. 59-4, c-myc ген человека расположен на хромосоме 8. Эта хромосома неизменно участвует в транслокации клеток лимфомы Беркитта. На уровне ДНК транслокация состоит в рекомбинации между c-myc локусом хромосомы 8 и локусом гена иммуноглобулина, расположенного обычно вблизи гена тяжелой цепи в хромосоме 14 или, реже, вблизи гена легкой цепи в хромосомах 2 или 22. По-видимому, эта транслокация не влияет на ту часть c-myc локуса, которая кодирует белок, но воздействует на регуляцию его экспрессии. Аналогичные транслокации, приводящие к рекомбинации между c-myc и генами иммуноглобулина имеют место и в плазмацитомах мышей.
Альтерации экспрессии гена с-abl в результате хромосомной транслокации при хроническом миелолейкозе. У большинства больных с хроническим миелолейкозом (ХМЛ) хромосома Рh' присутствует как в пораженных клетках, так и в поколениях нормальных клеток костного мозга. Считается, что при этом заболевании костный мозг и периферическая кровь заселены потомками кроветворной стволовой клетки, которые сохраняют способность дифференцироваться в красные кровяные клетки, мегакариоциты и гранулоциты. Однако пролиферация гранулоцитов аномальна и чрезмерна, что и вызывает клинические проявления ХМЛ. Гены, экспрессия которых альтерируется вследствие формирования филадельфийской хромосомы, должны рассматриваться как возможные виновники развития ХМЛ. Человеческий гомолог протоонкогена с-abl (см. табл. 59-1) расположен вблизи точки разрыва хромосомы 9 при транслокации 9—22 и при обмене переходит в хромосому 22. Оказалось, что в Рh`-хромосоме экспрессия с-аЫ претерпевает количественные и качественные изменения. Уровни c-abl РНК возрастают, а оба предоминантных РНК-транскрнпта гена и с-аЫ белка становятся больше, чем c-abl РНК и белковые молекулы нормальных клеток. Полагают, что РНК и белковые продукты c-abi локуса клеток ХМЛ включают в себя совокупный продукт c-abi и гена, называемого bcr (breakpoint claster region — область разрывного кластера), расположенного в точке разрыва на рекомбинантной Рh`-хромосоме Если эта альтерация c-abi и играет роль в развитии ХМЛ, то это должно проявляться на ранней стадии заболевания.
Амплифицированные протоонкогены в опухолях человека. Увеличение числа копий гена на клетку (амплификация гена) иногда проявляется на цитогенетическом уровне формированием небольших хромосомоподобных структур, называемых двойными малыми хромосомами, или появлением гомогенно окрашенных участков (ГОУ) в регуляторных хромосомах. ГОУ появляется в результате амплификации сегментов ДНК до такой степени, что это обнаруживается цитогенетически. Как следствие такая структура содержит множественные копии гена (генов), закодированных в данном сегменте ДНК. В нетрансформированных клетках амплификацию гена можно иногда индуцировать выращиванием клеток в специальных условиях. Например, клетки с амплифицированным геном дигидрофолатредуктазы, которая необходима для репликации ДНК, можно получить, если выращивать их (с последующим отбором) в присутствии небольшого количества метотрексата— ингибитора дигидрофолатредуктазы. При увеличении числа копий гена возрастает производство фермента в клетке и тем самым компенсируется действие ингибитора. Двойные малые хромосомы и ГОУ присутствуют во многих разновидностях опухолевых клеток, так что можно предположить, что гены, критические для роста неопластических клеток, могут амплифицироваться в процессе формирования опухоли.
Первым амплифицированным онкогеном, опознанным в опухолевых клетках человека, был ген c-myc, который экспрессировался на высоком уровне в одном случае промие.лоцитарного лейкоза как в исходных опухолевых клетках, так и в производных линиях клеток. Амплификация c-myc при этом заболевании оказалась редким событием и в других случаях промиелоцитарного лейкоза не наблюдалась. Однако двойные малые хромосомы, амплификация c-myc генов и повышенный уровень c-myc РНК наблюдались в ряде случаев рака желудка и мелкоклеточного рака легкого, а амплификация протоонкогена наблюдалась в двух линиях клеток из карциномы толстой кишки человека. Высокая частота двойных малых хромосом и ГОУ характерны для нейробластом человека. Ген, называемый N-myc и родственный гену c-myc, имеет высокий уровень амплификации и/или экспрессии в большинстве нейробластом, в производных от нейробластом линиях клеток и в других нейроэндокринных опухолях. Степень амплификации и/или экспрессии N-myc может сильно варьировать в пределах популяции опухолевых клеток.
Функция онкогенов. Изучение белков, кодируемых вирусными онкогенами и их нормальными клеточными гомологами, проясняет механизмы функционирования этих генов. Белковый продукт гена v-src вируса саркомы Рауса работает как тирозинпротеинкиназа, ферментная активность которой определяет онкогенные свойства v-src. Белковые продукты пяти других вирусных онкогенов (с шифрами fes/fps, yes, ros, abl, fgr) также оказались тирозинпротеинкиназами. Проблема состоит в том, чтобы идентифицировать ее клеточные белки, которые модифицируются этими киназами и являются критическими для трансформации. Например, в клетках, трансформированных вирусами саркомы Рауса, число клеточных белков модифицируется добавлением фосфатных групп к остаткам тирозина, однако роль таких изменений в онкогенезе не установлена.
Факторы роста и рецепторы. Существенный концептуальный прогресс произошел, в результате сравнения двух различных направлений исследования: механизмов функционирования онкогенов и механизмов функционирования фактора роста (рис. 59-3). Пролиферация и дифференциация нормальных клеток регулируется сигналами, поступающими от связей факторов роста с рецепторами на поверхности клеток. Наиболее изучены два фактора роста: тромбоцитарный фактор роста (ТФР), стимулирующий рост клеток соединительной ткани и гладких мышц, и эпидермальный фактор роста (ЭФР), необходимый для оптимального роста эпителиальных клеток in vitro. Рецепторы ТФР и ЭФР содержат тирозинпротеинкиназу, которая активируется связыванием с одним или с другим фактором роста соответственно. Имеют ли тирозинпротеинкиназы рецепторного и онкогенного происхождения общие белковые мишени внутри клеток, неизвестно.
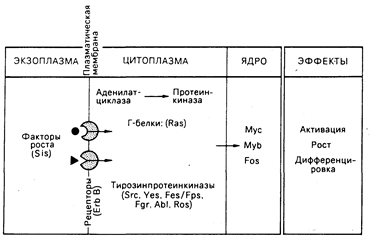
Рис. 59-3. Возможное отношение молекулярной биологии факторов роста к функции онкогенов.
Факторы роста — это небольшие молекулы, которые генерируют сигналы активации, репликации и дифференциации клетки, связываясь со специфическими рецепторами на поверхности клетки-мишени. Как показано, многие белки, производимые онкогенами, соответствуют генеральным путям активности фактора роста. Занимая на этих путях определенные позиции, онкогены могут трансформировать клетку, передавая конститутивные нерегулируемые сигналы роста. Подробности в тексте.
Белок, кодируемый онкогеном вируса саркомы обезьян sis, состоит в близком родстве с ТФР. Онкоген erb/B вируса эритробластоза птиц является, по-видимому, усеченной формой молекулы рецептора для ЭФР. Онкоген fms одного из штаммов вируса кошачьей саркомы может оказаться родственным рецептору фактора роста макрофагов, называемому CSF-1. Эти наблюдения позволяют предположить, что нерегулируемый рост при неопластических трансформациях определяется сигналом, поступающим от изменений в факторах роста, их рецепторах или в промежуточных элементах.
Белки онкогена ras. Белки, кодируемые онкогеном ras, ассоциированы с внутренней поверхностью клеточной мембраны, их функциональная активность, состоящая в связывании гуанозинтрифосфата (ГТФ), является вкладом в функциональную активность ГТФ-связывающих, или Г-белков. Обнаружено, что Г-белки могут ассоциировать с аденилатциклазным комплексом на внутренней поверхности клеточной мембраны и принимают участие в передаче сигналов от поверхности клетки, что в результате приводит к изменениям уровней внутриклеточных циклических нуклеотидов (см. гл. 67). В дрожжах гены ras действуют через пути аденилатциклазпротеинкиназы. Таким образом, может оказаться, что трансформирующие белки ras относятся к классу измененных Г-белков, передающих конститутивный сигнал роста.
Онкогенные белки в клеточном ядре. Белки, кодируемые тремя онкогенами — myb, myc, fos, — размещаются в клеточном ядре. В некоторых, но не во всех, клетках нормальный гомолог myb экспрессируется в фазе G1 клеточного цикла. Функционирование двух других генов представляется тесно связанным с механизмами действия фактора роста. Если фибробласты с остановленным ростом подвергнуть воздействию ТФР, то начинается экспрессия специфического набора генов (по оценкам, от 10 до 30), включая протоонкогены c-fos и с-mус, и уровни клеточной мРНК этих генов нарастают. Экспрессия с-mус стимулируется также в покоящихся Т- и В-лимфоцитах после воздействия соответствующими митогенами. После вхождения клетки в цикл роста экспрессия с-тус остается практически постоянной. После того как клетка утрачивает способность делиться, как, например, постмитотические, дифференцированные клетки, экспрессия с-тус прекращается. Таким образом, эти протоонкогены могут нормально функционировать как регуляторы «активации» роста и дифференциации клеток и служить ядерными мишенями для сигналов, генерируемых фактором роста. При альтерации или разрегулировании они могут обеспечить определяющий стимул нерегулируемого роста клетки и аномальной дифференциации, что характерно для неопластических состояний. Активность как myc-, так и myb-белков ДНК-зависима, но механизм действия ядерных белков неизвестен.
Экспериментальное введение активных онкогенов в половые клетки и в соматические стволовые клетки тканей. Один из способов исследования онкогенного потенциала опухоль-ассоциированных онкогенов заключается во введении активированных онкогенов в нормальные клетки in vivo и наблюдении за воздействием этих генов на дальнейшее развитие. В оплодотворенные яйцеклетки мышей методом микроинъекций было введено несколько различных генов, определяющих специфичность иммуноглобулина и гормона роста. Введенные «транс-гены» интегрировались в геном потомства и в некоторых случаях экспрессировались в клетках соответствующего типа (например, транс-гены иммуноглобулина экспрессировались преимущественно в В-лимфоцитах).
Введение посредством этой технологии гена Т-антигена из ДНК опухолевого вируса SV 40 в эмбрионы мышей привело к формированию папиллом сосудистой оболочки глаза у взрослых особей. Аналогично введение в эмбрионы мышей измененных с-тус транс-генов, содержащих промотор-усилительные последовательности, выделенных из вируса опухолей молочной железы мышей, вызывало развитие этой опухоли у некоторых из особей. По-видимому, введенный онкоген действовал как предрасполагающий фактор ускоренного развития карцином молочных желез, однако для полного развития опухолей у этих животных нужны, вероятно, какие-то дополнительные факторы.
Введение онкогенов в пригодные для трансплантации стволовые клетки костного мозга и лимфоидных органов было осуществлено путем инфицирования стволовых клеток ех vivo вирусными векторами, содержащими эти гены, с последующей трансплантацией зараженных клеток в ткани соответствующим образом подготовленных хозяев. Введение посредством этой методики гена v-myc в стволовые клетки фабрициевой сумки цыплят привело к образованию пренеопластических пролиферирующих повреждений, предшествующих развитию В-клеточных лимфом. При этом отсутствовала активация трансформирующих генов типа Blym-1, которая наблюдалась при более развитых новообразованиях данного вида. Следовательно, в этой системе активированный онкоген myc может быть ответственным за ранние пренеопластические стадии формирования лимфомы, в то время как для прогресса неоплазмы могут требоваться другие факторы, такие как активация Blym-1.
Онкогены и многостадийный опухолегенез. Рак у человека и химически индуцированные новообразования у животных обычно развиваются как многостадийный процесс, при котором аномальная пренеопластическая клетка разрастается в клеточную популяцию с преобладанием клонов со все более нарастающей злокачественностью. Считается, что эволюции развития опухоли предшествует латентный период, и весь процесс может занять значительную часть времени жизни пораженного индивида. Напротив, остротрансформирующие вирусы несут активированные формы тех онкогенов, которые участвуют в развитии рака невирусного происхождения и индуцируют новообразования в течение дней или недель; такая кинетика наводит на мысль об одностадийном процессе. Это различие может определяться несколькими факторами. Во-первых, многие вирусные онкогены кодируют киназы с многочисленными мишенями в клетке и поэтому могут вызывать резкие изменения, для реализации которых при медленно развивающихся новообразованиях потребовалось бы несколько различных мутаций. Во-вторых, экспрессия вирусных онкогенов управляется мощными регуляторами (промоторами и усилителями в провирусиых ДТП). Трансформирующий потенциал клеточных гомологов тех же самых генов может активироваться механизмами, не вызывающими столь высокого уровня экспрессии, например, точечными мутациями в 12-й или 61-й аминокислотных позициях белков, кодируемых человеческими опухоль-ассопиированными онкогенами ras. В таких ситуациях для образования трансформированного фенотипа может потребоваться согласованная активность нескольких генов, в то время как остротрансформирующие ретровирусы могут породить тот же фенотип за счет очень высокоуровневой нерегулируемой экспрессии всего одного из таких генов.
Эту точку зрения иллюстрируют эксперименты по трансфекции, в которых показана кооперация генов в процессе трансформации культуры клеток фибробластов. Активированные гены ras из клеток человеческой опухоли способны трансформировать иммортализованные линии клегок, но не могут вызвать полной морфологической трансформации первичных культур клеток. В то же время комбинация клонов с активированными генами туе и ras приводит к полной трансформации в первичных культурах клеток. Таким образом, в этой системе гены туе (и другие онкогены, которые сами по себе не альтерируют клетки) могут дополнить трансформирующую активность человеческих онкогенов ras. Однако, когда в активированный онкоген ras встраиваются мощные усилители транскрипции, этот ген может и сам трансформировать первичные культуры фибробластов, предположительно благодаря высокому уровню экспрессии этого онкогена. Таким образом, необходимосгь участия в трансформации многих генов может определяться, в частности, уровнем экспрессии онкогена, и в новообразованиях in vivo может активироваться более одного клеточного онкогена.
Исследование онкогенов и клиническая онкология. Вклад идентификации и анализа человеческих онкогенов в клинику может оказаться весьма значительным и даже революционным. Так, усилия но идентификации и контролю тех факторов питания и окружающей среды, которые могут вызывать или предотвращать рак, в основном опираются на методы эпидемиологии, опыты на животных и клинические испытания, при которых конечным пунктом измерений являются уровни заболеваемости и смертности. Знание же специфических протоонкогенов, служащих мишенями для внешних канцерогенов, и природы наведенных изменений может обеспечить лучшие методы для установления истинной роли кандидатов в канцерогены и для выработки превентивных мер. Новое слово в диагностике может сказать связь молекулярной анатомии неопластических изменений с определенными фазами последовательности клеточных поколений. Примером могло бы служить быстрое обнаружение альтераций с-аbl РНК и/или белка для анализа клеток хронического миелолейкоза. Знание молекулярных механизмов, посредством которых онкогены трансформируют клетки, позволило бы также более точно и специфично определить мишени для фармакологического воздействия.
Список литературы
Bishop J. M., Varmus H. Functions and origins of retroviral transforming genes. —
In:Molecular' Biology of Tumor Viruses: RNA Tumor Viruses, 2d ed./Eds.
R. Weiss et al. New York: Cold Spring Harbor Laboratory, 1982, 999—1108. Cohen S. The epidermal growth factor (EGF). — Cancer, 1983, 51, 1787. Cooper G. M., Lane M. A. Cellular transforming genes and oncogenes.—Biochirn.
biophys. Acta, 1984, 738, 9.
FialkowP.J. Clonal origin of human tumors. — Ann. Rev. Med., 1979, 30, 135. Hunter Т. The proteins of oncoge.ne.s. — Sci, Amer., 1984, 251, 70. Land H. et al. Cellular oncogenes and miiltistep carcinogens. --Science, 1983,
222, 771. Leder P. et ai. Translocation among antibody gene.s in cancer.-—Science, 1983,
222, 765. ". "Д Stiles С. D. The molecular biology of platelet-derived growth factor. — Cell, 1983,
33, 653.
Weinstein l. В. Multistage carcinogenesis involves multiple genes and multiple
mechanisms. — In: Cancer Cells/Eds. A. J. Levine et al. New York: Cold
Spring Harbor Laboratory, 1984, 229—237. Yunis J. J. The chromosomal basis of human neoplasia. — Science, 1983, 221, 227.
РАЗДЕЛ 2. КЛИНИЧЕСКАЯ ИММУНОЛОГИЯ
ГЛАВА 62. ВВЕДЕНИЕ В КЛИНИЧЕСКУЮ ИММУНОЛОГИЮ
Бартон Ф. Хайнес, Антоны С. Фаучи (Barton F. Haynes, Anthony S. Fauci)
Фундаментальные исследования в области иммунологии способствовали большим успехам многих клинических дисциплин, таких как аллергология, ревматология, неврология и кардиология. Применение моноклональных антител привело к революционным преобразованиям в области исследований поверхностных антигенов эффекторных и регуляторных клеток иммунной системы и дало возможность получать моноспецифические реагенты фактически к любым мишене-вым молекулам. Выделение, клонирование и секвенирование генов, кодирующих антигенные рецепторы на В-клетках (иммуноглобулины) и Т-клетках (a- и b-цепи Т-клеточного антигенного рецептора) и продукты главного комплекса гистосовместимости (HLA-антигены), позволили иметь в руках исследователей зонды. необходимые для понимания эффекторных функций иммунной системы: многообразия антигенных свойств Т- и В-клеток, индукции аутотолерантности (ареактивность к собственным антигенам организма) и регуляции роста и дифференцировки клеток иммунной системы. Технологические возможности молекулярной биологии дают возможность уже сейчас использовать различные генетические зонды для исследования и получения больших количеств секретируемых молекул (продуктов лимфоцитов — лимфокинов, продуктов моноцитов — монокинов), регулирующих функции иммунокомпетентных клеток. Наконец, открытие человеческих Т-клеточно-лимфотропных вирусов (HTLV), принадлежащих к семейству ретровирусов (см. гл. 293), которые вызывают некоторые формы лейкозов (HTLV типа I — Т-клеточный лейкоз взрослых) и иммунодефицита [HTLV типа III/LAV (вирус, ассоциированный с лимфаденопатией) —синдром приобретенного иммунодефицита (СПИД)], а также анализ генетических механизмов изменений Т-клеточного роста под воздействием HTLV во многом способствовали пониманию некоторых аспектов нормального и патологического роста клеток иммунной системы. Представления о существовании контроля роста и дифференцировки клеток иммунной системы открыли новые подходы к разработке специфических методов терапии заболеваний, связанных с расстройствами иммунорегуляции, среди которых можно назвать аутоиммунные и иммунодефицитные заболевания, а также злокачественные болезни иммунной системы. Цель данной главы — дать представление об основах иммунологии с особым рассмотрением тех принципов, которые помогут с базисных позиций понять многообразные клинико-лабораторные проявления расстройств иммунитета.
Фенотип и функция клеток иммунной системы. Двойственность иммунной системы состоит в сосуществовании происходящих из тимуса (Т-) и из костного мозга или аналога фабрициевой сумки (В-) лимфоцитов, ведущих свое происхождение из общей стволовой клетки. Другие типы клеток, такие как моноциты/макрофаги, играют основную роль в осуществлении индуктивной, регуляторной и эффекторной фаз иммунного ответа. К главным эффекторным и регуляторным клеткам иммунной системы относятся Т-, В-клетки, большие гранулярные лимфоциты и моноциты/макрофаги. Такие нелимфоидные клетки, как нейтрофилы, эозинофилы и базофилы, играют значительную роль в воспалительных реакциях, которые являются результатом активации иммунной системы и поэтому должны также рассматриваться как участники процессов выполнения клетками иммунной системы их функций (табл. 62-1). Количественный состав и распределение иммунокомпетентных клеток в различных тканях являются отражением процессов, связанных с транспортом клеток, их хоминг-характеристик и функциональных способностей. В костном мозге содержатся мультипотентные стволовые клетки, способные обеспечивать рост всем типам кроветворных клеток, а сам орган является основным депо в организме, где происходит созревание В-клеток, моноцитов/макрофагов и гранулоцитов. Т-клеточные предшественники также ведут свое происхождение из костно-мозговых стволовых клеток, однако покидают костный мозг незрелыми и для завершения дифференцировки мигрируют в тимус (хоминг-эффект). Зрелые Т-лимфоциты, В-лимфоциты и моноциты выходят в циркулягорное русло, а затем локализуются в периферических лимфоидных органах (лимфатические узлы, селезенка) и в ассоциированной с кишечником лимфоидной ткани (миндалины, пейеровы бляшки, аппендикс) и сохраняются там до момента активации их чужеродными антигенами. Зрелые миелоидные эффекторные клетки (нейтрофилы, эозинофилы, базофилы) покидают костный мозг и циркулируют в периферической крови или мигрируют в ткани для осуществления эффекторных функций, ассоциированных с ответом на чужеродные антигены (рис. 62-1).
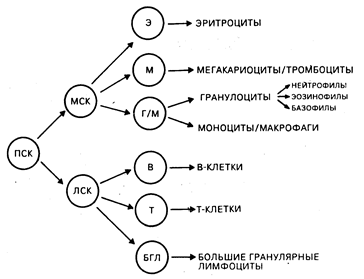
Рис. 62-1. Модель дифференцировки гемопоэтической стволовой клетки. Из гемопоэтической полипотентной стволовой клетки (ПСК) могут происходить более рестриктированные клетки-предшественники со способностью к самообновлению. Таким образом, лимфоцит-коммитированные стволовые клетки (ЛСК) обеспечивают рост Т-и В-клеткам. Другая группа гемопоэтических клеток, для которых непосредственным предшественником является более дифференцированная миелоидная стволовая клетка (МСК), включает эритроциты, мегакариоциты и тромбоциты, а также гранулоцитарный и моноцитарно-макрофагальный ростки. Происхождение больших гранулярных лимфоцитов изображено на схеме гипотетично (из М. D. Cooper et al.).
Таблица 62-1. Характеристики иммунных и воспалительных эффекторных клеток человека
| Тип клеток Функциональные поверхно- Клеточные функции, опосредуемые | ||
| стные молекулы | через поверхностные молекулы | |
| Т-лимфоцит | Т3/Т-клеточный рецептор- | Распознавание антигена, актива |
| ный комплекс для анти | ция Т-клеток | |
| Гена | ||
| Рецептор для эритроцитов | Активация Т-клеток | |
| барана (Т11-антиген) | ||
| Т4-антиген | Маркер индукторно-хелперных | |
| Т-клеток и субпопуляции цито- | ||
| токсических Т-клеток. Т4-моле- | ||
| кула облегчает распознавание | ||
| антигена Т4-клетками и явля | ||
| ется поверхностной распозна | ||
| вательной молекулой, через ко | ||
| торую вирус HTLV III/LAV | ||
| (СПИД) инфицирует эту суб | ||
| популяцию | ||
| Т8-антиген | Маркер супрессорных и цито- | |
| токсических клеток. Т8-моле- | ||
| кула облегчает распознавание | ||
| антигена Т8-клетками через | ||
| молекулы ГКСГ класса I | ||
| Рецептор для интерлей- | Имеется на активированных Т- | |
| В-лимфоцит | кина-2 (ИЛ-2) Поверхностные иммуно- | клетках, присоединяет ИЛ-2 Распознавание антигена, клеточ |
| глобулины (sig) | ная активация | |
| Fc-рецепторы для IgG | Присоединяют иммунные комп | |
| лексы | ||
| СЗ-рецепторы | Присоединяют иммунные комп | |
| лексы | ||
| Большой грану | Fc-рецепторы для IgG | Присоединяют иммунные комп |
| лярный лим | лексы | |
| фоцит (БГЛ) | ||
| Моноцит/мак | Fc-рецепторы для IgG | Присоединяют и фагоцитируют |
| рофаг | иммунные комплексы | |
| СЗ-рецепторы | Присоединяют и фагоцитируют | |
| иммунные комплексы | ||
| Антигены ГКСГ класса II | Представление антигена Т- и В- | |
| (1а) | клеткам | |
| Хемотаксические рецеп | Поляризация и хемотаксис кле | |
| Торы | ток | |
| Нейтрофил | Fc-рецепторы для IgG | Присоединяют и фагоцитируют |
| иммунные комплексы | ||
| Хемотаксические рецеп | Поляризация и хемотаксис кле | |
| Торы | ток | |
| СЗ-рецепторы | Присоединяют и фагоцитируют | |
| иммунные комплексы | ||
| Эозинофил | Fc-рецепторы для IgG | Присоединяют иммунные комп |
| лексы | ||
| СЗ-рецепторы | Присоединяют иммунные комп | |
| лексы | ||
| Базофил,тучная клетка | Fc-рецепторы для IgE СЗ-рецепторы | Опустошение гранул, содержащих медиаторы немедленной |
| гиперчувствительности после | ||
| перекрестного связывания при | ||
| крепленного к Fc-рецепторам | ||
| IgE с аллергеном (антигеном) |
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 632; Нарушение авторских прав?; Мы поможем в написании вашей работы!