
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эмоциональная реакция на диабет 1 страница
|
|
|
|
Аллергия к инсулину
Инсулиновая аллергия обусловлена антителами к инсулину класса IgE. Она проявляется немедленными реакциями с локальными болями или зудом, замедленными местными реакциями с плотным отеком, длящимися до 30 ч, и появлением генерализованной сыпи или анафилаксии. Системные реакции наблюдают обычно у тех больных, которые по тем или иным причинам прекращали инсулинотерапию, а затем возобновили ее. В таких случаях аллергическая реакция может возникать уже на вторую инъекцию инсулина. Легкие реакции можно снять антигистаминными препаратами.
Таблица 327-15. Инсулиновая десенсибилизация'
| Время.ч | Доза, ЕД | Способ введения |
| 0,001 | Внутрикожно | |
| 0,5 | 0,002 | » |
| 0,004 | Подкожно | |
| 1,5 | 0,01 | » |
| 0,02 | » | |
| 2,5 | 0,04 | » |
| 0,1 | » | |
| 3,5 | 0,2 | » |
| 0,5 | » | |
| 4,5 | » | |
| » | ||
| 5,5 | » | |
| » |
1После десенсибилизации вводят по 2—10 ЕД обычного инсулина каждые 4—6 ч в течение 24—36 ч. Переход к инсулину промежуточного действия осуществляют не ранее чем после шестой инъекции.
Схема J. A. Galloway. Подробности см. J. A. Galloway, R. Bressler, Med. din. North Amer., 62:663, 1978.
При тяжелом течении требуется десенсибилизация. Схема однодневной десенсибилизации приведена в табл. 327-15. После десенсибилизации прерывать инсулинотерапию уже нельзя.
Всегда трудно примириться с фактом хронического заболевания, требующего изменения всего образа жизни. Особенно это касается диабета, поскольку больные, как правило, сознают, что у них возможны поздние осложнения, а продолжительность жизни уменьшена. Поэтому неудивительно, что эмоциональная реакция на диабет часто мешает лечению. С одной стороны, первая реакция может быть отрицательной и больной отказывается от помощи. С другой стороны, возможен полный уход в болезнь. Врач должен сделать все, чтобы больной выбрал среднюю позицию, т. е. отдавал бы себе полный отчет в своем состоянии и в то же время разумно относился к нему, не впадая в отчаяние. Задача заключается в том, чтобы жить с диабетом, а не для него. Больные диабетом не отличаются от других больных в том плане, что они могут пытаться использовать свою болезнь для воздействия на близких и врача. Особенно остро эта проблема стоит у детей и подростков. Хотя психиатрические аспекты диабета здесь не рассматриваются, большинство трудностей можно предвидеть и преодолеть, если сочетать здравый смысл с симпатией к больному и твердостью. Следует также внушать больному осторожную надежду на то, что в будущем появятся лучшие, чем настоящее время, способы лечения.
ГЛАВА 328. ЛАКТАТ-АЦИДОЗ
Дэниел У. Фостер (Daniel W. Foster)
Лактат-ацидоз — распространенное состояние. Он обусловлен тем, что во всех случаях, когда оксигенация недостаточна для обеспечения энергетических потребностей, молочная кислота в скелетных мышцах и других тканях образуется с повышенной скоростью. Таким образом, лактат-ацидоз представляет собой общий конечный результат любых заболеваний, сопровождающихся циркуляторным коллапсом или гипоксией. Лактат-ацидоз может возникать и в отсутствие явной гипоксии тканей. В большинстве случаев его причину удается выяснить, но различают и «идиопатический» лактат-ацидоз.
Биохимические основы. В узком смысле биологическую жизнь можно определить как способность генерировать макроэргические фосфатные связи внутри клетки. Наиболее важным макроэргическим соединением является аденозинтрифосфат (АТФ), но и другие нуклеотиды, например гуанозитрифосфат, также играют существенную роль. Структура и функция любой ткани организма прямо или косвенно зависят от АТФ или эквивалентных макроэргических нуклеотидов. При гипоксии ткани АТФ не может образовываться в нужных количествах и возникает лактат-ацидоз. Он являеется метаболическим следствием активации запасной системы образования АТФ при нарушении основного энергопродуцирующего пути. Нормальный механизм генерации АТФ в аэробных условиях показан на рис. 328-1. При окислении субстратов, таких как свободные жирные кислоты или глюкоза, до ацетил-КоА входящие в их состав атомы водорода переносятся на никотинамидаденин-динуклеотид (НАД) с образованием восстановленной формы пиридиннуклеотида (НАД•Н). Окисление ацетил-КоА до СО, в цикле Кребса также приводит к образованию НАД*Н. Основное количество НАД«Н образуется в митохондриях, где происходит окисление жирных кислот и локализованы ферменты цикла трикарбоновых кислот; цитозольный НАД•Н должен попадать в митохондрии с помощью «челночных» систем, поскольку он не может непосредственно проникнуть через внутреннюю митохондриальную мембрану. В присутствии кислорода НАД•Н окисляется цепью транспорта электронов; конечным продуктом является вода («метаболическая вода»). На каждый моль НАД•Н, проходящий через последовательность цитохромов, образуется 2—3 моля АТФ. При нормальном содержании кислорода в тканях и высоких запасах АТФ скорость распада гликогена и окисления глюкозы мала (пастеровский эффект). И наоборот, при низком содержании кислорода запасы АТФ уменьшаются и распад гликогена и гликолиз активируются.

Рис. 328-1. Схема аэробного метаболизма.
Клеточные «отсеки» не указаны. Гликолиз протекает в цитозоле, тогда как ферменты окисления жирных кислот и цикла Кребса локализуются в митохондриях. Пунктирные линии означают, что в присутствии кислорода гликогенолиз и гликолиз заторможены (см. текст).
Рис. 328-2. Фосфофруктокиназа и гликолиз. Знак «минус» означает ингибирование, знак «плюс» — активацию (см. текст).
Регуляция гликолиза осуществляется в основном ферментом фосфофруктокиназой (ФФК). Как показано на рис. 328-2, этот фермент катализирует превращение фруктозо-6-фосфата во фруктозо-1, 6-дифосфат. Активность ФФК регулируется несколькими аллостерическими модуляторами. В мышцах и других тканях главным физиологическим ингибитором является АТФ, а сильным активатором — АМФ. В печени основным регулятором ФФК служит фруктозо-2,6-дифосфат (см. гл. 327). При нормальной концентрации фруктозо-2,6-дифосфата скорость гликолиза (глюкозо-6-фосфат ® пируват) высока, а глюконеогенез (пируват ® глюкозо-6-фосфат) заторможен. В мышцах концентрация фруктозо-2,6-дифосфата мала, и здесь он, как считают, не играет главной регулирующей роли. Концентрация фруктозо-2,6-дифосфата в печени при гипоксии падает, и метаболизм гепатоцитов сдвигается, таким образом, в сторону глюконеогенеза. Эта адаптивная реакция способствует поглощению и утилизации лактата в условиях, когда ускоряется его образование вне печени. Сокращение мышцы активирует распад гликогена и продукцию молочной кислоты, но парадоксально, что концентрация фруктозо-2,6-фосфата при сокращении снижается. Это подтверждает точку зрения о том, что активность фосфофруктокиназы и гликолиз в мышце регулируются в основном отношением АТФ/АМФ, а не фруктозо-2,6-дифосфатом.
Последовательность событий, возникающих при гипоксии ткани, схематически представлена на рис. 328-3. Когда кровоток в периферических тканях снижается настолько, что количество кислорода становится меньше, чем необходимо для удовлетворения энергетических потребностей, поток электронов по цепи их транспорта нарушается или блокируется (все цитохромы оказываются восстановленными). Из-за этого блока НАД•Н, который продолжает образовываться до последней минуты, не может быть окислен, что приводит к росту отношения НАД•Н/НАД как в митохондриях, так и в цитозоле. В результате все равновесные реакции, в которых роль кофактора играет НАД•Н, сдвигаются в сторону восстановления (например, оксалоацетат ® малат, пируват ® лактат), замедляя поток субстратов через многие критические пункты. Кроме того, в таких условиях не происходит синтеза АТФ и его концентрация в ткани снижается. Соответственно увеличивается уровень АДФ и АМФ. В результате активируется фосфофруктокиназа, что ускоряет распад гликогена и окисление глюкозы. Ускорение гликолиза приводит к гипепродукции пировиноградной кислоты, которая из-за повышенного содержания в клетке НАД•Н восстанавливается в молочную кислоту. Проще говоря, ацидоз при тканевой гипоксии обусловлен превращением нейтрального субстрата гликоген/глюкоза в сильную пировиноградную кислоту. Это именно лактат-ацидоз, так как высокое отношение НАД•Н/НАД сдвигает лактатдегидрогеназную реакцию вправо. Перечисленные изменения показаны на рис. 328-4.
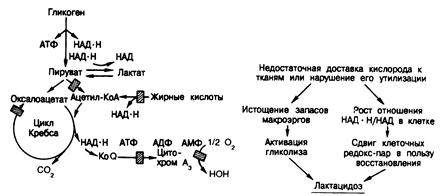
Рис. 328-3. Схема анаэробного метаболизма.
Заштрихованными кубиками показаны пункты метаболической блокады, обусловленной недостаточным поступлением кислорода в ткани и высоким отношением НАД'Н/НАД. Жирными стрелками показано ускорение гликогенолиза, гликолиза и образования лактата. Гликолиз продолжается, несмотря на высокое отношение НАД'Н/НАД в цитозоле, потому, что при образовании каждой молекулы лактата высвобождается одна молекула НАД (используемая в глицеральдегид-3-фосфатдегидрогеназной реакции).
Рис. 328-4. Схема биохимических механизмов лактацидоза.
Даже при нормальном снабжении кислородом в некоторых тканях организма человека продуцируется лактат. Он попадает в печень, где вступает на путь глюконеогенеза, превращаясь в глюкозу (цикл Кори). Снижение поглощения лактата печенью, несомненно, играет роль в патогенезе лактат-ацидоза (особенно у больных с сосудистым коллапсом, тяжелым поражением клеток печени или недостаточностью ферментов глюконеогенеза), но выраженный ацидоз, вероятно, невозможен без гиперпродукции лактата на периферии. Все ли ткани при лактат-ацидозе продуцируют избыточные количества лактата или только некоторые, неизвестно.
Теоретически ускорение гликолиза, вызываемое гипоксией, можно рассматривать как альтернативную систему продукции АТФ в условиях нарушения нормального митохондриального механизма. Однако система гликолиза неэффективна. Один моль глюкозы, образующейся из гликогена и полностью окисляющейся в цикле Кребса, дает 37 молей АТФ, тогда как выход АТФ при превращении гликогена в пируват составляет только 3 моля. Тем не менее на короткое время гликолитическая продукция АТФ может оказаться жизненно важной.
Клинические проявления. Лактат-ацидоз проявляется тошнотой, рвотой, возбуждением и дыханием типа Куссмауля, иногда наступает ступор или кома. Huckabee, который в 1961 г. привлек к проблеме лактат-ацидоза внимание клиницистов, различал две большие группы больных с повышенной концентрацией лактата в крови. Больные 1-й группы характеризовались пропорциональным увеличением уровней лактата и пирувата без признаков гипоксии. У больных 2-й группы содержание лактата было непропорционально высоким по сравнению с умеренной концентрацией пирувата. Huckabee предложил термин «избыток лактата» для любого повышения его уровня, которое нельзя было бы отнести на счет повышения концентрации пирувата, и объяснил наличие такого избытка тканевой гипоксией (высоким отношением НАД"Н/НАД). Связь концентрации лактата и пирувата с отношением НАД-Н/НАД в цитоплазме становится очевидной при преобразовании лактатдегидрогеназной реакции:

Простой способ расчета «избытка лактата» показан на рис. 328-5. В среднем уровень лактата в венозной крови в норме составляет около 1 мМ (0,6— 1,5 мМ), а концентрация пирувата—примерно 0,1 мМ(0,05—0,15мМ)1. Если при точном определении отношение лактат/пируват превышает 10—15, то это указывает, как правило, на определенную степень гипоксии. На практике уровень пирувата обычно не определяют, так как его нестабильность и низкая концентрация делают это затруднительным. Поэтому избыток лактата редко выражают количественно. Однако концепция оказалась плодотворной, поскольку способствовала пониманию патофизиологии лактат-ацидоза.
Cohen и Woods предложили классификацию лактат-ацидоза, основанную не на величине отношения лактат/пируват, а на клинических проявлениях (табл. 328-1). Лактат-ацидоз типа А обусловлен недостаточной перфузией или оксигенацией тканей. В эту группу входят большинство больных с лактат-ацидозом. Причиной чаще всего служит сосудис-

Рис. 328-5. Концепция избытка лактата (ИЛ).
Литерами Л3 и П3 обозначены концентрации лактата и пирувата соответственно в плазме больного, а материалами Л3 и П3 — средние концентрации этих соединений у здоровых лиц.
1 При определении содержания лактата и пирувата необходимо соблюдать меры предосторожности: пробы должны храниться на льду, а эритроциты (которые продуцируют лактат) нужно отделять немедленно.
Таблица 328-1. Некоторые причины лактат-ацидоза
А. Лактат-ацидоз при гипоксии
1. Интенсивная работа мышц (судороги, охлаждение)
2. Недостаточная перфузия или оксигенация тканей любой этиологии1 Б. Лактат-ацидоз без видимой гипоксии
1. Системные клинические состояния [алкалоз (дыхательный или метаболический); декомпенсированный сахарный диабет; лейкемия, лимфома, другие злокачественные процессы; тяжелые поражения печени; недостаточность тиамина]
2. Фармакологические вещества, гормоны, токсины (фенформин и другие бигуаниды; салицилаты; нитропруссид натрия; этанол; адреналин, глюкагон; фруктоза, сорбитол)
3. Ферментативные нарушения (глюкозо-6-фосфатаза; фруктозо-1,6-дифосфатаза; пируваткарбоксилаза; пируватдегидрогеназа; невыясненные нарушения в цикле трикарбоновых кислот)
4. Некоторые первичные миопатии
5. Идиопатический лактат-ацидоз
1Чаще всего причинами нарушения перфузии и оксигенации служат инфаркт миокарда, сепсис, кровотечение, снижение объема жидкости, легочная эмболия и сердечная недостаточность. Гораздо реже отмечают гипоксию, обусловленную тяжелыми легочными заболеваниями, хронической анемией, вдыханием угарного газа и отравлением цианидами. ПоСоЬеп a. Woods, 1976.
тый коллапс, и любое состояние, ведущее к шоку (например, инфаркт миокарда, эмболия легких, кровотечение, септицемия, отравление), способно вызвать лактат-ацидоз. Гипоксии при этом может и не быть. Важно отметить, что ухудшение перфузии тканей иногда происходит и без выраженного снижения артериального давления. Физиологический лактат-ацидоз возникает всегда, когда при работе мышц создается кислородный долг. Эквивалентом этого состояния в патологии является лактат-ацидоз, вызываемый судорогами или охлаждением с длительной дрожью. У всех больных с лактат-ацидозом типа А отмечают «избыток лактата» (по терминологии Huckabee).
У больных с лактат-ацидозом типа Б концентрация лактата в крови повышена, но признаков снижения перфузии тканей нет. Ацидоз может быть тяжелым, легким или его может вообще не быть. В крови возможно повышение содержания и лактата, и пирувата, но при тяжелом ацидозе отношение лактат/пируват возрастает. К системным клиническим состояниям, характеризующимся повышением уровня лактата в крови, относятся некомпенсированный сахарный диабет, тяжелые поражения печени, лейкоз, недостаточность тиамина и метаболический или дыхательный алкалоз. Лактат-ацидоз часто возникает у больных диабетом при лечении бигуанидами. Поэтому Управление санитарного надзора за качеством пищевых продуктов и медикаментов США изъяло фенформин из клинической практики. Этот синдром возникает также при применении нитропруссида, передозировке адреналина и в отдельных случаях интоксикации другими веществами. Большинство последних, несомненно, вызывает гипоксию или шок, и поэтому соответствующие больные должны быть отнесены к типу А. В качестве причины лактат-ацидоза часто называют этанол, но в действительности он редко вызывает этот синдром. Окисление этанола печенью обусловливает высокое отношение НАД•Н/НАД в клетках и, по всей вероятности, блокирует обратное превращение лактата (и аланина) в глюкозу. Дети с недостаточностью ферментов гликолиза—глюконеогенеза—цикла трикарбоновых кислот особенно предрасположены к лактат-ацидозу и часто погибают. При некоторых первичных миопатиях, характеризующихся патологией митохондрий, встречается рецидивирующий лактат-ацидоз. Для митохондриальных миопатий типичны «рвано-красные волокна» при модифицированной окраске по Гомори и причудливой формы митохондрии (см. гл. 355). Причиной лактат-ацидоза служат, вероятно, разнообразные нарушения в цепи транспорта электронов обусловливающие невозможность образования АТФ при повышении потребностей в нем, например, при физической нагрузке. В большинстве случаев так называемого идиопатического лактат-ацидоза, скорее всего, также имеют место какие-то изменения митохондрий.
Патофизиологические механизмы накопления лактата при других формах заболевания типа Б варьируют и зачастую недостаточно изучены. Основной причиной может быть снижение печеночного поглощения лактата, связанное с ферментативными нарушениями или злоупотреблением алкоголем; например, умеренное повышение продукции лактата под влиянием гормонов или физической нагрузки в условиях ограниченной способности печени экстрагировать лактат из крови приведет к ацидозу. Фармакологические вещества, которые не уменьшают перфузии тканей, каким-то образом, вероятно, изменяют функцию митохондрий Такие гормоны, как глюкагон и адреналин, повышают уровень лактата, стимулируя гликолиз. При лейкозе, по-видимому, происходит как непосредственная гиперпродукция лактата массой лейкоцитов, так и увеличение вязкости крови, что ограничивает капиллярный кровоток.
Большинство состояний типа Б сопровождается лишь умеренной лактацидемией, и для развития ацидоза нужны дополнительные стимулы. К последним могут относиться инфекции дегидратация, уменьшение объема крови, голодание или чрезмерная физическая нагрузка. Легкое нарушение перфузии тканей (недостаточное, чтобы отнести заболевание к типу А), вызываемое перечисленными факторами, усугубляет основной патологический процесс; развивается выраженный ацидоз.
Диагностика. Диагноз лактат-ацидоза ставят при наличии значительного метаболического ацидоза и настолько высокой концентрации лактата, которая могла бы быть основной причиной снижения содержания бикарбоната в плазме крови. Как правило, рН артериальной крови должен быть ниже 7,2, а концентрация лактата в плазме — больше 12 мМ Однако часто «лактат-ацидоз» диагностируют при незначительном повышении концентрации лактата в плазме (3—6 мМ) и почти нормальном рН. Существует много причин повышения уровня лактата в плазме, но термин «лактат-ацидоз» следовало бы употреблять лишь при тех состояниях, при которых действительно имеется ацидоз. Трудности возникают и тогда, когда у больного выявляют тяжелый ацидоз, но концентрация лактата не настолько высока, чтобы обусловить падение уровня бикарбоната (т. е. имеется смешанный ацидоз). Например, при диабетическом кетоацидозе концентрация лактата составляет 3—6 мМ, но снижение рН обусловлено в основном ацетоацетатом и b-гидроксибутиратом.
Лактат-ацидоз следует подозревать всякий раз, когда метаболический ацидоз сопровождается наличием «анионной щели», но причина отсутствия анионов остается неясной. «Анионную щель» можно рассчитать несколькими способами; простейший из них следующий-[Na+]—([Cl–] + [НСО3–]). В норме этот показатель колеблется от 8 до 16 мМ/л, в среднем около 12 мМ/л. Четырьмя наиболее распространенны ми причинами метаболического ацидоза с «анионной щелью» являются диабетический или алкогольный кетоацидоз, уремический ацидоз, лактат-ацидоз и ацидоз, вызываемый приемом токсических веществ (салицилаты метанол, этиленгликоль, паральдегид). Таким образом, в отсутствие кетоацидоза и уремии, а также каких-либо указаний на отравление вероятность того, что метaбoлический ацидоз со значительной «анионной щелью» обусловлен лактат-ацидозом, становится достаточно большой.
Лечение Если лактат-ацидоз вызван шоком или гипоксией, коррекция этих состоянии приводит и к исчезновению вторичного ацидоза. Традиционное лечение предусматривает также внутривенное введение больших количеств бикарбоната натрия. Сомнения в оправданности такого подхода связаны с экспериментальными данными о неблагоприятном эффекте бикарбонатной терапии у собак с лактат-ацидозом, вызванным гипоксией. Значение этих данных для человека неясно, хотя лечение бикарбонатом и не очень эффективно Пока в этом вопросе нет ясности, лечение целесообразно начинать с инфузии 1—2 л 0,9% солевого раствора для увеличения объема жидкости в организме, а затем уже, если не наступит улучшения, переходить на инфузию бикарбоната. Показания к применению бикарбоната основаны на том, что тяжелый и длительный ацидоз сам по себе может вызывать сосудистый коллапс. Растворы бикарбоната готовят следующим образом: для получения изотонического раствора 150 мл (3 флакона по 50 мл) бикарбоната натрия (1 ммоль/мл) добавить к 850 мл стерильной дистиллированной воды. В некоторых случаях могут потребоваться гипертонические (5%) растворы, которые имеются в продаже.
У лиц пожилого возраста и больных с нарушенной функцией почек введение больших объемов бикарбоната может вызвать перегрузку жидкостью. Когда дефицит жидкости полностью ликвидирован, наряду с интенсивной ощелачивающей терапией следует вводить диуретики. Иногда для профилактики отека легких требуется перитонеальный диализ или гемодиализ с использованием гипертонических растворов, тогда как для коррекции лактат-ацидоза диализ не показан.
Успешно скорригировать лактат-ацидоз у человека удалось дихлорацетатом. Считается, что это вещество стимулирует окисление пирувата и лактата путем активации пируватдегидрогеназной реакции. Хотя при длительном применении дихлорацетат вызывает полиневропатию, повреждение тестикул, катаракты и нарушения метаболизма оксалатов, Stacpoole и сотр. не отметили серьезных токсических последствий при однократном его введении в дозе 50 мг/кг массы тела. Эффект одной дозы сохраняется в течение нескольких часов. К сожалению, несмотря на уменьшение ацидоза, большинство больных все же погибли. Это могло бы подтверждать точку зрения, согласно которой лактат-ацидоз служит предвестником надвигающейся смерти от какого-либо тяжелого заболевания, а не основной ее причиной. Для оценки возможности применения дихлорацетата в клинике необходимы дальнейшие исследования.
ГЛАВА 329. ГИПОГЛИКЕМИЯ; ИНСУЛИНОМА И ДРУГИЕ ГОРМОНАЛЬНО-АКТИВНЫЕ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Дэниел У. Фостер, Артур Г. Рубинштейн (Daniel W. Foster, Arthur H. Rubinstein)
Сохранение постоянной концентрации глюкозы в плазме — необходимое условие здоровья. Опасность гипогликемии (в короткие промежутки времени более опасной, чем гипергликемия) объясняется тем, что глюкоза служит основным энергетическим субстратом для мозга. В отсутствие глюкозы, как и кислорода, нарушается функция мозга, возникает повреждение ткани, и, если дефицит сохраняется достаточно долго, наступает смерть. Чувствительность мозга к гипогликемии обусловливается тем, что в отличие от других тканей организма он не способен использовать свободные жирные кислоты крови в качестве источника энергии. Короткоцепочечные метаболиты свободных жирных кислот — ацетоуксусная и b-гидроксимасляная кислоты («кетоновые тела») эффективно окисляются мозгом и при умеренной концентрации в плазме могут защищать центральную нервную систему от повреждений, вызываемых гипогликемией. Однако, поскольку кетоз развивается в течение нескольких часов, кетогенез не может служить эффективным механизмом защиты от острой гипогликемии. Таким образом, для сохранения функции центральной нервной системы на ранних стадиях голодания или в условиях гипогликемии требуется быстрое увеличение продукции глюкозы печенью. Одновременно уменьшается использование глюкозы периферическими тканями, которые «переключаются» на альтернативный субстрат — свободные жирные кислоты. Эти адаптивные механизмы контролируются гормонами и в обычных условиях достаточно эффективны. Однако иногда система разрушается или не справляется с нагрузкой, что приводит к возникновению клинического синдрома гипогликемии.
Механизмы защиты от гипогликемии. Механизмы развития гипогликемических состояний легче всего понять, если вкратце рассмотреть нормальный метаболизм энергетических субстратов. В обычных условиях энергетические потребности организма удовлетворяются экзогенными веществами, поступающими с пищей. Окисление молекул, входящих в состав пищевых продуктов, до двуокиси углерода и воды сопровождается образованием аденозинтрифосфата (АТФ) — главного макроэргического соединения организма. В каком-то смысле жизнь можно определить как постоянную способность производить АТФ (и аналогичные макроэргические нуклеотиды) для поддержания любых проявлений клеточной активности. Когда потребление калорий превышает сиюминутные энергетические потребности, как это бывает после обычного приема пищи, избыток субстратов накапливается в форме жира, структурного белка и гликогена. Поток субстратов в этой фазе, называемой анаболической, движется от кишечника к печени, в места утилизации и накопления. Основной гормон, регулирующий анаболическую фазу обмена веществ, — это инсулин; уровень контррегуляторных гормонов в этот период снижен.
Катаболическая стадия обмена веществ начинается примерно через 5—6 ч после еды. В нормальных условиях единственный существенный период метаболизма — это ночное голодание, но иногда, в частности при тяжелых заболеваниях, этот период может длиться гораздо дольше. В период голодания/катаболизма происходит ряд обменных сдвигов, направленных на то, чтобы сохранить уровень глюкозы в плазме в границах, обеспечивающих безопасность центральной нервной системы и в то же время сохранить энергетическое снабжение других тканей организма. Такая перестройка осуществляется двумя механизмами. Во-первых, активируется образование глюкозы в печени, а во-вторых, большинство других тканей переключается на использование липидов. Вначале глюкоза, высвобождающаяся из печени, почти целиком образуется из печеночного гликогена. Однако поскольку печень человека содержит в среднем лишь около 70 г доступного гликогена, гликогенолиз способен поддерживать нужный уровень глюкозы в плазме только короткое время (обычно не более 8—10 ч). При физической нагрузке, стрессе или тяжелых заболеваниях этот период значительно сокращается. Чтобы компенсировать снижение уровня гликогена, быстро начинается глюконеогенез, при котором возникает поток субстратов от мышц и жировой ткани в печень и далее к местам утилизации. Предшественниками в синтезе глюкозы служат лактат/пируват и аминокислоты (в основном аланин) из мышц и глицерин, высвобождаемый жировой тканью в результате липолиза.
Переключение на жировой тип обмена достигается путем активации гормончувствительной липазы в жировой ткани; этот фермент гидролизует запасенные триглицериды с образованием длинноцепочечных жирных кислот и глицерина. Судьба первых двояка. Большая их часть (в норме около 120 г в сутки) используется непосредственно, а остальная (примерно 40 г в сутки) окисляется в печени до ацетоуксусной и b-гидроксимасляной кислот. Эти кетоновые тела могут эффективно использоваться в качестве источников энергии большинством тканей (причем самой печенью лишь в минимальной степени), но их основная роль, как уже отмечалось, — служить запасным субстратом для мозга. Переключение большинства тканей на питание липидами важно потому, что преимущественная утилизация свободных жирных кислот и кетоновых тел вместо глюкозы обеспечивает сохранение последней для использования центральной нервной системой.
Катаболическая стадия обмена веществ опосредуется снижением концентрации инсулина в плазме наряду с усилением секреции четырех контррегуляторных гормонов: глюкагона, адреналина, кортизола и гормона роста. Кроме того, непосредственно в тканях из симпатических нейронов высвобождается норадреналин. Главное значение в поддержании уровня глюкозы придают глюкагону, тогда как адреналин играет дублирующую, или второстепенную, роль. Адреналин в качестве средства защиты от гипогликемии приобретает основное значение при сахарном диабете, когда реакция глюкагона очень рано исчезает (см. гл. 328).
Анаболическая и катаболическая стадии обмена веществ отражены в табл. 329-1. Нарушение любого из адаптивных механизмов может привести к гипогликемии.
Таблица 329-1. Цикл еда—голодание
| Стадия | Основной гормон | Субстраты в плазме | Направление потока субстратов | Активируемый процесс |
| Анаболическая' | Инсулин | Глюкоза | От органов брюшной полости к местам утилизации и накопления | Накопление гликогена |
| Триглицериды | Синтез белка | |||
| Аминокислоты с разветвленной цепью | Образование триглицеридов | |||
| ¯ Свободные жирные кислоты | ||||
| ¯ Кетоновые тела | ||||
| Катаболическая2 | Глюкагон | ¯ Глюкоза | От мест накопления в печень и места утилизации | Гликогенолиз |
| ¯ Триглицериды | Глюконеогенез | |||
| Аланин и глутамин3 | Протеолиз | |||
| Свободные жирные кислоты | Липолиз | |||
| Кетоновые тела | Кетогенез |
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 512; Нарушение авторских прав?; Мы поможем в написании вашей работы!