
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы ф-х исследований
|
|
|
|
ФХ
1. Один моль водяных паров обратимо и изотермически сконденсировали в жидкость при 100 С. Рассчитайте работу, теплоту, изменение внутренней энергии и энтальпии в этом процессе. Удельная
теплота испарения воды при 100 С равна 2260 Дж×г–1.
Решение: В процессе H2O(г)→H2O(ж) произошло обратимое сжатие газа при постоянном давлении p = 1 атм от объема V 1 = nRT / p = 0.082×373 = 30.6 л до объема одного моля жидкой воды V 2»0.018 л. Работа сжатия при постоянном давлении равна:
W = – p (V 2 – V 1)» pV 1 = 101.3 кПа ×30.6 л = 3100 Дж.
При испарении одного моля воды затрачивается теплота - 2260 Дж×г–1 ×18 г = 40700 Дж, поэтому при конденсации одного моля воды эта теплота, напротив, выделяется в окружающую среду: Q = –40700 Дж. Изменение внутренней энергии можно рассчитать по первому закону:
D U = Q + W = –40700 + 3100 = –37600 Дж,
а изменение энтальпии – через изменение внутренней энергии:
D H = D U + D(pV) = D U + p D V = D U – W = Q = –40700 Дж.
Изменение энтальпии равно теплоте, т.к. процесс происходит при постоянном давлении.
Ответ: W = 3100 Дж, Q = D H = –40700 Дж, D U = –37600 Дж.
2. Рассчитайте энтальпию реакции 6C(г) + 6H(г) = C6H6(г) а) по энтальпиям образования; б) по энергиям связи, в предположении, что двойные связи в молекуле C6H6 фиксированы.
Решение: а) Энтальпии образования (в кДж×моль–1) находим в Приложении (табл. П-5, П-6): Df H (C6H6(г)) = 82.93, Df H (C(г)) = 716.68, Df H (H(г)) = 217.97.
Энтальпия реакции равна: Df H = 82.93 – 6×716.68 – 6×217.97 = –5525 кДж×моль–1.
б) В данной реакции химические связи не разрываются, а только образуются. В приближении фиксированных двойных связей молекула C6H6 содержит 6 связей CH, 3 связи CC и 3 связи C=C. Энергии связей (в кДж×моль–1) (Приложение, табл. П-4): E (CH) = 412, E (CC) = 348, E (C=C) = 612.
Энтальпия реакции равна: Df H = –(6×412 + 3×348 + 3×612) = –5352 кДж×моль–1.
Разница с точным результатом –5525 кДжмоль обусловлена тем, что в молекуле бензола нет одинарных связей CC и двойных связей C=C, а есть 6 ароматических связей CC.
Ответ: а) –5525 кДж×моль–1; б) –5352 кДж×моль–1.
3. Пользуясь справочными данными, рассчитайте энтальпию реакции 3Cu(тв) + 8HNO3(aq) = 3Cu(NO3)2(aq) + 2NO(г) + 4H2O(ж) при 298 К.
Решение: Сокращенное ионное уравнение реакции имеет вид:
3Cu(тв) + 8H+(aq) + 2NO3-(aq) = 3Cu2+(aq) + 2NO(г) + 4H2O(ж).
По закону Гесса, энтальпия реакции равна:
Dr H = 4×Df H (H2O(ж)) + 2×Df H (NO(г)) + 3×Df H (Cu2+(aq)) – 2×Df H (NO3–(aq)) (энтальпии образования меди и иона H+ равны, по определению, 0). Подставляя значения энтальпий образования (Приложение, табл. П-5), находим:
Dr H = 4×(–285.8) + 2×90.25 + 3×64.77 – 2×(–205.0) = –358.4 кДж
(в расчете на три моля меди).
Ответ: –358.4 кДж.
4. Рассчитайте изменение энтропии при нагревании 0.7 моль моноклинной серы от 25 до 200 °С при давлении 1 атм. Мольная теплоемкость серы равна: 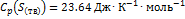 ,
,  . Температура плавления моноклинной серы 119 °С, удельная теплота плавления 45.2
. Температура плавления моноклинной серы 119 °С, удельная теплота плавления 45.2 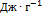 . Решение. Общее изменение энтропии складывается из трех составляющих: 1) нагревание твердой серы от 25 до 119 °С, 2)плавление, 3) нагревание жидкой серы от 119 до 200 °С.
. Решение. Общее изменение энтропии складывается из трех составляющих: 1) нагревание твердой серы от 25 до 119 °С, 2)плавление, 3) нагревание жидкой серы от 119 до 200 °С. 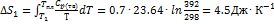 .
. 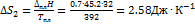 .
. 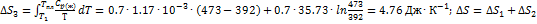 +
+  Ответ. 11.88
Ответ. 11.88 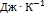
5. Используя основное уравнение термодинамики, найдите зависимость энтальпии от давления при постоянной температуре: а) для произвольной системы; б) для идеального газа. Решение: а) Если основное уравнение в форме (5.1.б) поделить на dp при постоянной температуре, получим: 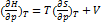 ; Производную энтропии по давлению можно выразить с помощью соотношения Максвелла (5.7.г):
; Производную энтропии по давлению можно выразить с помощью соотношения Максвелла (5.7.г): 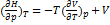 ; б) Для идеального газа V(T) =
; б) Для идеального газа V(T) = 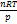 . Подставляя эту функцию в последнее тождество, получим:
. Подставляя эту функцию в последнее тождество, получим: 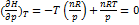 ; Энтальпия идеального газа не зависит от давления.
; Энтальпия идеального газа не зависит от давления.
6. Рассчитайте состав раствора бензол – толуол, который при нормальном давлении кипит при температуре 100 C, а также состав образующегося пара. Раствор считайте идеальным. Давления пара
чистых бензола и толуола при 100 C равны 1350 Торр и 556 Торр соответственно.
Решение: Мольную долю бензола в растворе находим по закону Рауля: 760 = 556 + (1350 – 556)× x 1,
откуда x 1 = 0.257. Мольная доля толуола в растворе равна - x 2 = 1 – x 1 = 0.743. Мольная доля бензола в паре равна - 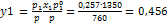
Соответственно, мольная доля толуола в паре равна: y 2 = 1 – y 1 = 0.544.
7. Рассчитайте изменение давления, необходимое для изменения температуры плавления льда на 1 C. При 0 C энтальпия плавления льда равна 333.5 Дж×г–1, удельные объемы жидкой воды и льда равны V ж. = 1.0002 см3×г–1 и V тв. = 1.0908 см3×г–1.
Решение: Изменение объема при плавлении льда равно: V ж. – V тв. = 1.0002 – 1.0908 = –0.0906 см3×г–1 = –9.06×10–8 м3×г–1.
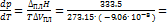 –1.348×107 (Па×К–1) = –133 атм×К–1.
–1.348×107 (Па×К–1) = –133 атм×К–1.
Таким образом, при повышении давления на 133 атм температура плавления льда понижается на 1 градус. Знак «минус» показывает, что при повышении давления температура плавления понижается.
Ответ: D p = 133 атм.
8. Рассчитайте растворимость висмута в кадмии при 150 и 200 °С. Энтальпия плавления висмута при температуре плавления (273 °С) равна 10.5 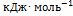 . Примите, что образуется идеальный раствор и энтальпия плавления не зависит от температуры. Решение. Воспользуемся формулой
. Примите, что образуется идеальный раствор и энтальпия плавления не зависит от температуры. Решение. Воспользуемся формулой 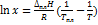 ; При 150°С:
; При 150°С: 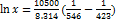 , откуда х = 0.510. При 200 °С:
, откуда х = 0.510. При 200 °С: 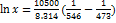 , откуда х = 0.700. Растворимость увеличивается с температурой, что характерно для эндотермического процесса. Ответ:х = 0.510 при 150 °С и х = 0.700 при 200 °С.
, откуда х = 0.700. Растворимость увеличивается с температурой, что характерно для эндотермического процесса. Ответ:х = 0.510 при 150 °С и х = 0.700 при 200 °С.
9. Для реакции 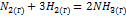 при 298 К Кр = 6.0
при 298 К Кр = 6.0 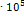 , а
, а 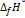 (
(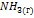 ) = -46.1
) = -46.1 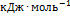 . Оцените значение константы равновесия при 500 К.. Решение. Стандартная мольная энтальпия реакции равна
. Оцените значение константы равновесия при 500 К.. Решение. Стандартная мольная энтальпия реакции равна 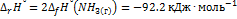 . Согласно уравнению (9.18.6),
. Согласно уравнению (9.18.6), 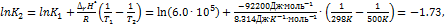 откуда
откуда 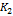 = 0.18. Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что согласуется с принципом Ле-Шателье.
= 0.18. Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что согласуется с принципом Ле-Шателье.
10. 1При 312 К и давлении 1.21 Торр на поверхности микропористого глинистого адсорбента сорбируется 1.37 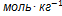 паров метилового спирта. Такая же адсорбция достигается при повышении температуры до 320К и увеличении давления до 3.16 Торр. Вычислите энтальпию адсорбции метилового спирта при данной степени заполнения поверхности. Решение. Энтальпия адсорбции равна
паров метилового спирта. Такая же адсорбция достигается при повышении температуры до 320К и увеличении давления до 3.16 Торр. Вычислите энтальпию адсорбции метилового спирта при данной степени заполнения поверхности. Решение. Энтальпия адсорбции равна 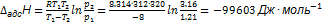 .
.
11. Растворимость AgCl в воде при 25 °C равна 1.33×10–5 моль×кг–1. Рассчитайте: а) стандартную энергию Гиббса для реакции AgCl(тв) = Ag+(aq) + Cl–(aq); б) растворимость AgCl в 0.01 моль×кг–1 водном растворе KNO3.
Решение: а) Константа равновесия для реакции AgCl(тв) = Ag+(aq) + Cl–(aq)
равна K = a (Ag+)× a (Cl–)×= g±2 m 2. Ионная сила раствора: I = m = 1.33×10–5 моль×кг–1. Тогда: lg g±= –0.510×(1.33×10–5)0.5, откуда g±= 0.996.
Следовательно, K = 0.9962×(1.33×10–5)2 = 1.75×10–10. Отсюда D G °= – RT ln K = +55.7 кДж×моль–1.
б) Ионная сила 0.01 моль×кг–1 раствора KNO3: I = m = 0.01 моль×кг–1. Тогда: lg g±= –0.510×(0.01)0.5,
откуда g±= 0.889. m = K 0.5 / g±= (1.75×10–10)0.5 / 0.889 = 1.49×10–5.
12. Удельная электропроводность 0.135 моль×л–1 раствора пропионовой кислоты C2H5COOH равна 4.79×10–2 См×м–1. Рассчитайте эквивалентную электропроводность раствора, константу диссоциации кислоты и pH раствора, если предельные подвижности H+ и C2H5COO– равны 349.8 См×см2×моль–1 и 37.2 См×см2×моль–1 соответственно.
Решение: l0 = 349.8 + 37.2 = 387.0 См×см2×моль–1. 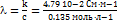 = 3.55 См×см2×моль–1.
= 3.55 См×см2×моль–1.
a=l/l0 = 3.55/387.0 = 0.009. 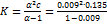 = 1.15×10–5 (моль×л–1).
= 1.15×10–5 (моль×л–1).
[H+] = a× c = 1.24×10–3(моль×л–1). pH = –lg[H+] = 2.91.
Ответ: l= 3.55 См×см2×моль–1; a= 0.009; K = 1.15×10–5 моль×л–1; pH = 2.91.
13. Удельная электропроводность раствора Mg(NO3)2 с массовой долей 5% при 18 °C равна 4.38 См×м–1, а его плотность – 1.038 г×см–3. Рассчитайте эквивалентную электропроводность раствора и кажущуюся степень диссоциации соли в растворе. Подвижности ионов Mg2+ и NO3– при 18 °C равны соответственно 44.6 и 62.6 См×см2×г-экв–1.
Решение: 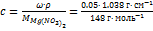 = 0.35 моль×л–1 = 0.70 г-экв×л–1.
= 0.35 моль×л–1 = 0.70 г-экв×л–1. 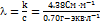 = 62.5 См×см2×г-экв–1. l0 = 44.6 + 62.6 = 107.2 См×см2×г-экв–1. a= l/l0 = 62.5/107.2 = 0.583.
= 62.5 См×см2×г-экв–1. l0 = 44.6 + 62.6 = 107.2 См×см2×г-экв–1. a= l/l0 = 62.5/107.2 = 0.583.
Ответ: l= 62.5 См×см2×г-экв–1, a= 0.583.
14. Составьте схему гальванического элемента, в котором протекает реакция Ag+ + Br– = AgBr. Рассчитайте стандартную ЭДС элемента при 25 °C, D G °и константу равновесия реакции и растворимость AgBr в воде.
Решение: Ag | AgBr| Br– || Ag+ | Ag
Правый электрод: Ag+ + e = Ag, E = 0.799 В.
Левый электрод: AgBr + e = Ag + Br–, E = 0.073 В.
Общая реакция: Ag+ + Br– = AgBr, E = 0.726 В. D G° = – nFE° = –(96485 Кл×моль–1)(0.726 В) = –70.05 кДж×моль–1, 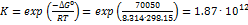 ;
;
 = a (Ag+)× a (Br–) = m (Ag+)× m (Br–)(g±)2 = m 2×(g±)2.
= a (Ag+)× a (Br–) = m (Ag+)× m (Br–)(g±)2 = m 2×(g±)2.
Отсюда, полагая g±= 1, получаем m = 7.31×10–7 моль×кг–1.
15. 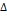 Н реакции Pb +
Н реакции Pb + 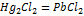 + 2Hg, протекающей в гальваническом элементе, равно -94.2
+ 2Hg, протекающей в гальваническом элементе, равно -94.2 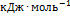 при 298.2 К. ЭДС этого элемента возрастает на 1.45
при 298.2 К. ЭДС этого элемента возрастает на 1.45 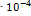 В при повышении температуры на 1 К. Рассчитайте ЭДС элемента и
В при повышении температуры на 1 К. Рассчитайте ЭДС элемента и 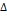 S при 298.2 К. Решение.
S при 298.2 К. Решение. 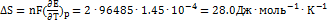 ;
; 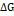 =
= 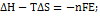 откуда
откуда 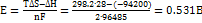 . Ответ.
. Ответ.  = 28.0
= 28.0 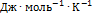 ; Е= 0.531 В.
; Е= 0.531 В.
16. В некоторой молекуле есть три электронных уровня энергии: 0, 1500 и 2800 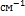 . Нижний уровень невырожден, средний - трехкратно вырожден, высший - пятикратно вырожден. Найдите среднюю электронную энергию молекулы (в
. Нижний уровень невырожден, средний - трехкратно вырожден, высший - пятикратно вырожден. Найдите среднюю электронную энергию молекулы (в 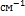 ) и заселенность нижнего уровня при температуре 1900 К. Значение постоянной hc/k= 1.44 см
) и заселенность нижнего уровня при температуре 1900 К. Значение постоянной hc/k= 1.44 см  К. Решение. Используя распределение Больцмана, рассчитаем заселенности электронных уровней, т.е. относительные количества молекул на этих уровнях:
К. Решение. Используя распределение Больцмана, рассчитаем заселенности электронных уровней, т.е. относительные количества молекул на этих уровнях: 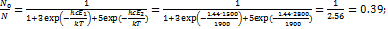 (множитель hc использован для перевода
(множитель hc использован для перевода 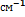 в Дж);
в Дж); 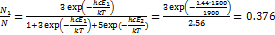 ;
;  Среднюю электронную энергию можно найти, сложив энергии отдельных уровней, умноженные на заселенности этих уровней:
Среднюю электронную энергию можно найти, сложив энергии отдельных уровней, умноженные на заселенности этих уровней: 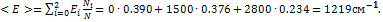 Ответ. 1219
Ответ. 1219 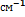 ; 39.0%.
; 39.0%.
17. Сумма по состояниям некоторой термодинамической системы, состоящей из N одинаковых частиц равна: Z(T, V, N) = const 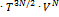 . Найдите внутреннюю энергию, энтропию и уравнение состояния этой системы. Решени е. Найдем логарифм суммы по состояниям: In Z = const' +
. Найдите внутреннюю энергию, энтропию и уравнение состояния этой системы. Решени е. Найдем логарифм суммы по состояниям: In Z = const' + 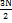 In T + N InV и воспользуемся формулами:
In T + N InV и воспользуемся формулами: 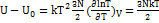 ;
; 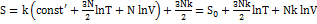 , где S0 не зависит от T и V.
, где S0 не зависит от T и V. 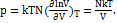 Данная система - идеальный газ.
Данная система - идеальный газ.
18. Рассчитайте мольные энтропию, внутреннюю энергию, энтальпию, энергии Гельмгольца и Гиббса газообразного азота при Т= 298 К и давлении 1 атм. Вращательная постоянная В = 2.00 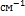 , колебательная частота
, колебательная частота 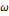 = 2360
= 2360 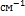 . Электронной и ядерной составляющими пренебречь. Решение. Колебательным вкладом здесь можно пренебречь, т.к. температура Т = 298 К намного меньше эффективной колебательной температуры
. Электронной и ядерной составляющими пренебречь. Решение. Колебательным вкладом здесь можно пренебречь, т.к. температура Т = 298 К намного меньше эффективной колебательной температуры 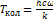 = 3400 К. Рассчитаем поступательную и вращательную суммы по состояниям:
= 3400 К. Рассчитаем поступательную и вращательную суммы по состояниям: 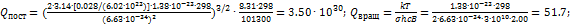 Внутреннюю энергию можно найти по теореме о распределении по степеням свободы:
Внутреннюю энергию можно найти по теореме о распределении по степеням свободы: 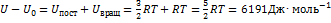 , мольную энтальпию - по определению Н= U + pV:
, мольную энтальпию - по определению Н= U + pV: 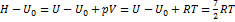 = 8667
= 8667 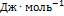 . Мольную энтропию находим по формулам:
. Мольную энтропию находим по формулам: 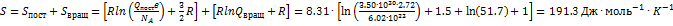 . а энергии Гельмгольца и Гиббса - по определениям F = U - TS и G = F+pV:
. а энергии Гельмгольца и Гиббса - по определениям F = U - TS и G = F+pV:  = -50820
= -50820 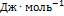 ,
,  -50820 + 8.31
-50820 + 8.31  298 = -48340
298 = -48340 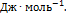
19. В реакции второго порядка А + В 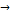 D начальные концентрации веществ А и В равны, соответственно, 2.0
D начальные концентрации веществ А и В равны, соответственно, 2.0 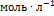 и 3.0
и 3.0 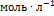 .Скорость реакции равна 1.2
.Скорость реакции равна 1.2 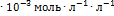 при [А] = 1.5
при [А] = 1.5 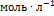 . Рассчитайте константу скорости и скорость реакции при [В] = 1.5
. Рассчитайте константу скорости и скорость реакции при [В] = 1.5 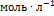 . Решение. По закону действующих масс, в любой момент времени скорость реакции равна: г = к[А][В]. К моменту времени, когда [А] = 1.5
. Решение. По закону действующих масс, в любой момент времени скорость реакции равна: г = к[А][В]. К моменту времени, когда [А] = 1.5 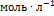 , прореагировало по 0.5
, прореагировало по 0.5 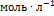 веществ А и В, поэтому [В] = 3 - 0.5 = 2.5
веществ А и В, поэтому [В] = 3 - 0.5 = 2.5 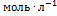 . Константа скорости равна:
. Константа скорости равна: 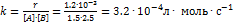 . К моменту времени, когда [В] = 1.5
. К моменту времени, когда [В] = 1.5 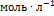 , прореагировало по 1.5
, прореагировало по 1.5 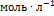 веществ А и В, поэтому [А] = 2 - 1.5 = 0.5
веществ А и В, поэтому [А] = 2 - 1.5 = 0.5 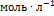 . Скорость реакции равна:
. Скорость реакции равна: 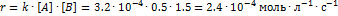
20. Установлено, что реакция второго порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0.24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0.16 М? Решение. Запишем два раза решение (18.13) кинетического уравнения для реакции второго порядка с одним реагентом: 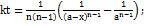
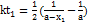 ;
;  , где, по условию, a = 0.24 М,
, где, по условию, a = 0.24 М, 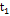 = 92 мин,
= 92 мин, 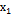 = 0.75-0.24 = 0.18 М,
= 0.75-0.24 = 0.18 М, 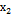 = 0.24-0.16 = 0.08 М. Поделим одно уравнение на другое:
= 0.24-0.16 = 0.08 М. Поделим одно уравнение на другое: 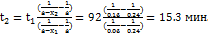
21. Реакция первого порядка при температуре 70 °С завершается на 40% за 60 мин. При какой температуре реакция завершится на 80% за 120 мин, если энергия активации равна 60 кДжмоль? Решение. Для реакции первого порядка константа скорости выражается через степень превращения следующим образом:  , где
, где 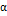 = х/а - степень превращения. Запишем это урав-е при двух температурах с учетом уравнения Аррениуса:
= х/а - степень превращения. Запишем это урав-е при двух температурах с учетом уравнения Аррениуса: 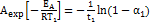 ;
; 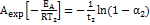 , где
, где 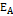 = 60
= 60 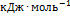 ,
, 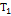 = 343 К,
= 343 К,  = 60 мин,
= 60 мин, 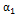 = 0.4,
= 0.4, 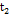 = 120 мин,
= 120 мин, 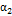 = 0.8. Поделим одно уравнение на другое и прологарифмируем:
= 0.8. Поделим одно уравнение на другое и прологарифмируем:  . Подставляя в это выражение приведенные выше значения, находим
. Подставляя в это выражение приведенные выше значения, находим 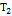 =351K= 78°С.
=351K= 78°С.
22. Используя квазистационарное приближение, определите скорость образования продукта по схеме: 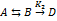 . Pешение. Применим к промежуточному веществу В условие квази-стационарности:
. Pешение. Применим к промежуточному веществу В условие квази-стационарности: 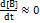 ;
;  ; Откуда
; Откуда 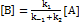 . Скорость образования продукта:
. Скорость образования продукта: 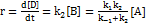 . Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
. Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
1. Стандартный раствор меди приготовлен растворением 0,854 г 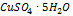 в 1,00 литре воды и добавлением аммиака. Из него приготовлен 10 окрашенных стандартов, содержащих от 1,00 до 10,00 мл раствора в 20 мл воды. Навеска 0,52 г исследуемого вещества растворена в 250,00 мл воды. После взаимодействия 5,00 мг исследуемого вещества с аммиачным раствором и разбавления до 20 мг интенсивность окраски раствора получилась равной интен-и окраски восьмого стандарта. Вычислить содержание меди (в %) в исследуемом веществе.
в 1,00 литре воды и добавлением аммиака. Из него приготовлен 10 окрашенных стандартов, содержащих от 1,00 до 10,00 мл раствора в 20 мл воды. Навеска 0,52 г исследуемого вещества растворена в 250,00 мл воды. После взаимодействия 5,00 мг исследуемого вещества с аммиачным раствором и разбавления до 20 мг интенсивность окраски раствора получилась равной интен-и окраски восьмого стандарта. Вычислить содержание меди (в %) в исследуемом веществе.
Решение. Согласно условиям задачи интенсивность окраски меди в исследуемого растворе совпадает с интенсивностью окраски восьмого стандарта. Содержание меди в восьмом стандарте (в г) равно: 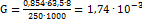 ; где 63,5-атомный вес меди; 250-молекулярный вес
; где 63,5-атомный вес меди; 250-молекулярный вес 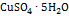 . Так как ошибка за счет самого измерения составляет 2-5%, все расчеты можно вести с точностью до третьей значащей цифры. По условию задачи
. Так как ошибка за счет самого измерения составляет 2-5%, все расчеты можно вести с точностью до третьей значащей цифры. По условию задачи 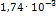 г меди соответствует 5 мл исследуемого раствора, а следова-о, во всем растворе содержится меди (в г):
г меди соответствует 5 мл исследуемого раствора, а следова-о, во всем растворе содержится меди (в г): 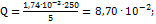 Содержание меди в % равно
Содержание меди в % равно 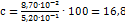 .
.
2. Для определения хрома в стали приготовили стандартный раствор, содержащий 0,75 г 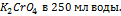 Навеску металла 0,500 г растворили в кислоте и после окисления хрома до хромата раствор разбавили до 200 мл. Полученный раствор сравнивали со стандартом, причем для уравнения окрасок 6,80 мл стандартного раствора разбавили водой до 25,00 мл. Вычислить содержание хрома в стали (%). Решение: Содержание хрома в растворе сравнения (в г) равно:
Навеску металла 0,500 г растворили в кислоте и после окисления хрома до хромата раствор разбавили до 200 мл. Полученный раствор сравнивали со стандартом, причем для уравнения окрасок 6,80 мл стандартного раствора разбавили водой до 25,00 мл. Вычислить содержание хрома в стали (%). Решение: Содержание хрома в растворе сравнения (в г) равно: 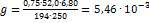 ; Так как интенсивность окраски обоих растворов одинакова, то, зная объем раствора сравнения и содержание хрома в нем, можно вычислить содержание хрома в исследуемом растворе (в%):
; Так как интенсивность окраски обоих растворов одинакова, то, зная объем раствора сравнения и содержание хрома в нем, можно вычислить содержание хрома в исследуемом растворе (в%): 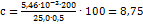
3. Для определения марганца приготовлен стандартный раствор 0,01н раствор 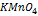 . Из навески сплава 0,500 г после соответствующей обработки получено 150,0 мл раствора, содержащего марганец в виде
. Из навески сплава 0,500 г после соответствующей обработки получено 150,0 мл раствора, содержащего марганец в виде 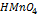 . Три пробы этого раствора сравнивали в калориметре при
. Три пробы этого раствора сравнивали в калориметре при  =5,00 см; интенсивности окрасок были равны при
=5,00 см; интенсивности окрасок были равны при 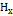 8,52; 8,50;8,46 см. Вычислить содержание марганца в пробе (в %). Решение. Среднеарифметическое значение для
8,52; 8,50;8,46 см. Вычислить содержание марганца в пробе (в %). Решение. Среднеарифметическое значение для 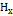 равно:
равно: 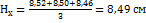 . Отсюда
. Отсюда 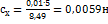 ; Содержание марганца (в%):
; Содержание марганца (в%): 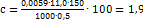 , где 11,0-эквивалентный вес Mn в
, где 11,0-эквивалентный вес Mn в  по реакции с
по реакции с  .
.
4. При фотометрическом определении титана в растворе, содержащем 0,45 мкг титана в 1 мл, в кювете с толщиной слоя 5 см было получено отклонение по шкале гальванометра 90мкА. Для падающего светового потока отклонение по шкале гальванометра было 155 мкА. Определить молярный коэффициент поглощения окрашенного соединения. Решение. Для решения используем уравнение Бугера-Ламберта-Бера: 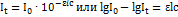 ; Рассчитываем концентрацию титана (в моль/л):
; Рассчитываем концентрацию титана (в моль/л): 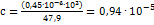 ; Из приведенного выше уравнения получаем:
; Из приведенного выше уравнения получаем: 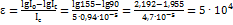 .
.
5. Молярный коэффициент поглощения комплекса бериллияс ацетилацетоном в хлороформе для волны 295нм равен 31600. Какое минимальное содержание бериллия (в%) можно определить в навеске 1г, растворенной в 50 мл в кювете с толщиной слоя 5 см, принимая минимальный отсчет по шкале оптической плотности фотоколориметра 0,025? Решение. Применяя закон Бугера-Ламберта-Бера,получаем: 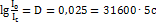 ;
; 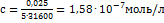 ; Рассчитываем содержание бериллия (в г/50 мл):
; Рассчитываем содержание бериллия (в г/50 мл): 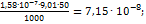 Отсюда содержание бериллия (в %) равно:
Отсюда содержание бериллия (в %) равно:  .
.
6. На фотокалориметре для падающего светового потока отсчет по шкале гальванометра был 100 делений. Для стандартного раствора комплекса меди 0,0050М с избытком аммиака отсчет по шкале гальванометр был 85,8 делений. Определить концентрацию меди (в мкг/мл) в растворе, если для него отсчет по шкале гальванометра равен 93,5 деления. Оценить точность определения, если точность отсчета по шкале гальванометра 0,5 деления. Решенение. Составляем 2 уравнения по закону Бургера-Ламберта-Бера: для стандартного раствора: 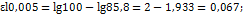 Для исследуемого образца:
Для исследуемого образца: 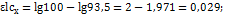 Разделив эти уравнения одно на другое, получаем:
Разделив эти уравнения одно на другое, получаем: 
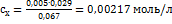 . Рассчитываем концентрацию меди (в мкг/мл):
. Рассчитываем концентрацию меди (в мкг/мл): 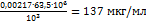 .
.
7. Сколько кислорода и водорода выделится при электролизе серной кислоты в течение 15 минут, если сила тока 2,5А? РЕШЕНИЕ: Через раствор прошло количество электричества, равное 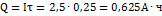 При прохождении 26,8
При прохождении 26,8 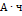 выделяется 1 г
выделяется 1 г 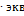 кислорода, т.е 8 г, при прохождении 0,625
кислорода, т.е 8 г, при прохождении 0,625 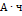 выделится
выделится 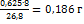 . При прохождении 26,8
. При прохождении 26,8 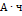 выделяется 1 г
выделяется 1 г 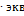 водорода, занимающий объем 11,2 л; следовательно, при прохождении 0,625
водорода, занимающий объем 11,2 л; следовательно, при прохождении 0,625 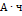 выделится:
выделится: 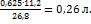
8. Сопротивление 5%-раствора 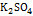 в ячейке с электродами площадью 2,54
в ячейке с электродами площадью 2,54 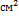 и расстояние между ними 0,65 см равно 5,61Ом.Плотность раствора считать равной 1. Определить эквивалентную электропроводность раствора. Решение: Определяем электропроводность раствора:
и расстояние между ними 0,65 см равно 5,61Ом.Плотность раствора считать равной 1. Определить эквивалентную электропроводность раствора. Решение: Определяем электропроводность раствора: 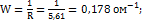 Определяем удельную электропроводность раствора:
Определяем удельную электропроводность раствора: 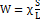 ;
; 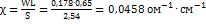 ; Рассчитываем число грамм-эквивалентов
; Рассчитываем число грамм-эквивалентов 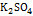 в 1
в 1 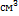 исследуемого раствора:
исследуемого раствора: 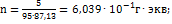 Рассчитаем эквивалентную электропроводность:
Рассчитаем эквивалентную электропроводность: 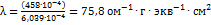 .
.
9. Удельная электропроводность 0,0109 Н раствора  равна 1,02
равна 1,02 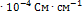 . Определите константу диссоциации
. Определите константу диссоциации  . РЕШЕНИЕ: Определяем эквивалентную электропроводность раствора:
. РЕШЕНИЕ: Определяем эквивалентную электропроводность раствора:  По табл.значениям подвижностей ионов
По табл.значениям подвижностей ионов 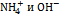 рассчитываем эквивалентную электропроводность при бесконечном разбавлении:
рассчитываем эквивалентную электропроводность при бесконечном разбавлении: 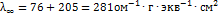 ; Рассчитываем степень диссоциации:
; Рассчитываем степень диссоциации: 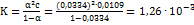 .
.
10. Вычислить потенциал медного электрода в растворе 0,01М по хлориду меди и 0,01М по сульфату меди при 30 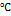 .Какая ошибка будет внесена,если не учитывать коэффициент активности ионов меди? РЕШЕНИЕ: Потенциал медного электрода рассчитывают по уравнению Нернста:
.Какая ошибка будет внесена,если не учитывать коэффициент активности ионов меди? РЕШЕНИЕ: Потенциал медного электрода рассчитывают по уравнению Нернста: 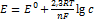 , где
, где 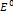 -нормальный окислительно-восстановительный потенциал пары
-нормальный окислительно-восстановительный потенциал пары 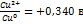 ; n-число электронов; с-концентрация ионов меди;
; n-число электронов; с-концентрация ионов меди; 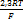 при 30
при 30 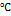 равно 0,060. Подставляя данные задачи, получаем:
равно 0,060. Подставляя данные задачи, получаем:  Для вычисления активности
Для вычисления активности 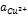 рассчитываем ионную силу раствора по уравнению
рассчитываем ионную силу раствора по уравнению 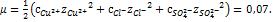 По справочнику(Лурье Ю.Ю-справочник по аналитической химии) находим величину коэффициента активности для двухзарядных ионов:
По справочнику(Лурье Ю.Ю-справочник по аналитической химии) находим величину коэффициента активности для двухзарядных ионов: 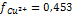 Подставляя полученные данные в урав-е Нернста, вычисляем величину потенциала
Подставляя полученные данные в урав-е Нернста, вычисляем величину потенциала 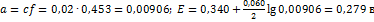 . Следовательно, ошибка, если не учитывать активность ионов, будет 0,299-0,279=0,020 в. В прямых потенциометрических анализах такой ошибкой пренебрегать нельзя.
. Следовательно, ошибка, если не учитывать активность ионов, будет 0,299-0,279=0,020 в. В прямых потенциометрических анализах такой ошибкой пренебрегать нельзя.
11. Вычислить произведение растворимости(ПР) хлорида серебра при 18 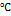 ,если потенциал серебряного электрода в насыщенном растворе хлорида серебра 0,518 В относительно водородного электрода. РЕШЕНИЕ: Потенциал серебряного электрода равен
,если потенциал серебряного электрода в насыщенном растворе хлорида серебра 0,518 В относительно водородного электрода. РЕШЕНИЕ: Потенциал серебряного электрода равен 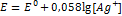 . По таблицам находим для серебра
. По таблицам находим для серебра 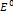 =0,800 в. Отсюда 0,518=0,800+0,058
=0,800 в. Отсюда 0,518=0,800+0,058 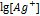 . 0,058
. 0,058 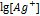 =-0,800+0,518=-0,282;
=-0,800+0,518=-0,282; 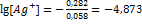 ,
, 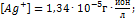 ПР=(
ПР=(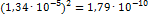 .
.
12. ЭДС элемента Pt(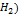 |раствор кислоты| 1н каломельный полэлемент при 28
|раствор кислоты| 1н каломельный полэлемент при 28  равна 0,571В.Вычислить концентрацию ионов водорода и рН раствора. РЕШЕНИЕ: ЭДС равна
равна 0,571В.Вычислить концентрацию ионов водорода и рН раствора. РЕШЕНИЕ: ЭДС равна 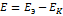 . Откуда
. Откуда 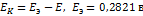 ;
;  ;
; 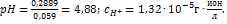
13. При добавлении к 100 мл раствора HCl, содержащего угольную кислоту 1,5 мл 0,01Н соляной кислоты потенциал индикаторного электрода изменился с 190 до 210В. Рассчитать концентрацию НСl в растворе, если Т=25 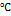 . РЕШЕНИЕ: Составляем два уравнения для вычисления потенциала до и после добавления раствора:
. РЕШЕНИЕ: Составляем два уравнения для вычисления потенциала до и после добавления раствора: 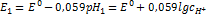 ;
; 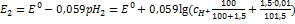 ;
; 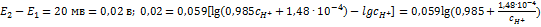 ;
; 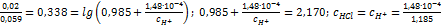 .
.
14. Как выражается энергия взаимодействия ядра, обладающего ненулевым спином, с внешним магнитном полем? РЕШЕНИЕ: 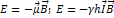 ;
;  – гиромагнитное отношение;
– гиромагнитное отношение; 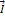 – результирующая сил;
– результирующая сил; 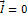 – при четных значениях протонов и нейтронов;
– при четных значениях протонов и нейтронов; 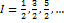 - при разной четности (чет-нечет, нечет-чет);
- при разной четности (чет-нечет, нечет-чет); 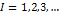 - нечет-нечет
- нечет-нечет
15. Запишите условие ядерного магнитного резонанса для двухуровневой системы. Запишите выражение для резонансной частоты через индукцию поля. РЕШЕНИЕ: 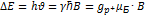 ;
; 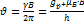 .
.
16. Определите размер молекулы HBr, если наиболее дальний инфракрасный спектр ее состоит из линий, разделенных интервалом ∆σ=17 см-1. РЕШЕНИЕ: 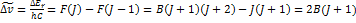 ;
; 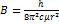 ;
; 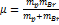 ;
;  .
.
17. Определить амплитуду колебаний молекулы водорода, если частота ее колебаний в основном состоянии равна 1,32×1014с-1. РЕШЕНИЕ: 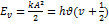 ;
;  ;
; 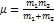 ;
; 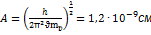 .
.
18. Определить энергию диссоциации молекулы водорода, если частота ее колебаний в основном состоянии равна 1,32×1014с-1, а постоянная ангармоничности х=0,0285.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 3729; Нарушение авторских прав?; Мы поможем в написании вашей работы!