
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выберите один или несколько правильных ответов
|
|
|
|
Типовые задачи
Задача 1.Рассчитать молярную концентрацию эквивалента раствора нитрита натрия, содержащего 13,8 г соли в 200 см3 раствора. Какой объем раствора перманганата калия с молярной концентрацией эквивалента 0,5 моль/дм3 потребуется на титрование 10 см3 исходного раствора нитрита натрия?
| Дано: | Решение: |
| m(NaNO2) = 13,8 г | 1. В процессе реакции осуществляется переход: NaNO2 => NaNO3, т.е. N+3 – 2e => N+5 |
| Vр(NaNO2) = 200 см3 | |
| С(1/5KMnO4) = 0,5 моль/дм3 | М(½ NaNO2) = 69: 2 = 34,5 г/моль 2. Найти С(½ NaNO2): |
| Vр(NaNO2) = 10 см3 | |
| Vр(KMnO4) =? С(½ NaNO2) =? | m (NaNO2) 13,8 С(½ NaNO2) = ----------------------- = ------------- = 2 моль/дм3 M(½ NaNO2) · V 34,5 · 0,2 |
| 3. Найти объем раствора перманганата калия: По закону эквивалентов: С(½ NaNO2) · V(NaNO2) = C(1/5KMnO4) · V(KMnO4) | |
| С(½ NaNO2) · V(NaNO2) 2 · 10 V(KMnO4) = ------------------------------------- = ---------- = 40 см3 C(1/5KMnO4) 0,5 | |
| Ответ: С(½ NaNO2) = 2 моль/дм3; V(KMnO4) = 40 см3 |
Задача 2. На титрование раствора пероксида водорода в кислой среде израсходовано 25 см3 раствора перманганата калия с t(KMnO4) = 0, 008 г/см3. Рассчитать массу пероксида водорода, содержащегося в исходном растворе.
| Дано: | Решение: | |
| t(KMnO4) = 0,008 г/см3 | 1. В процессе реакции осуществляется переход: | |
| V(KMnO4) = 25 см3 | H2O2 — 2e → O2 + 2H+ | |
| m(H2O2) =? | Mn+7 + 5e → Mn+2 | |
| M(½Н2О2) = 34: 2 = 17 (г/моль) | ||
| М(⅕KMnO4) = 158: 5 = 31,6 (г/моль) | ||
| 2. Рассчитать массу KMnO4, израсходованного на титрование: m(KMnO4) = t(KMnO4) · V(KMnO4) = 0,008 · 25 = 0,2 (г) 3. По закону эквивалентов: n(½H2O2 ) = n(⅕KMnO4 ), т. е. m(H2O2) m(KMnO4) ---------------- = --------------------- M(½Н2О2) М(⅕KMnO4) m(KMnO4) · M(½Н2О2) 17 · 0,2 откуда m(H2O2) = ----------------------------------- = ------------ = 0,108 (г) М(⅕KMnO4) 31,6 | ||
| Ответ: m(H2O2) = 0,108 г Задача 3. Какую массу щавелевой кислоты Н2С2О4 · 2Н2О необходимо взять для приготовления 200 см3 раствора щавелевой кислоты с молярной концентрацией эквивалента С (½ Н2С2О4 · 2Н2О) = 0,02 моль/дм3? | ||
| Дано: | Решение: | |
| С(½Н2С2О4 · 2Н2О) = 0,02 моль/дм3 | 1. В процессе реакции осуществляется переход: | |
| Vр(Н2С2О4 ) = 200 см3 = 0,2 дм3 | С2О42– - 2е → 2СО2 | |
| m(Н2С2О4 · 2Н2О) =? | М(½Н2С2О4 · 2Н2О) = 126: 2 = 63 г/моль | |
| 2. Рассчитать m(Н2С2О4 · 2Н2О): m(Н2С2О4 · 2Н2О) = М(½Н2С2О4 · 2Н2О) · С(½Н2С2О4 · 2Н2О) · Vр m(Н2С2О4 · 2Н2О) = 63 · 0,02 · 0,2 = 1,26 (г) Ответ: m(Н2С2О4 · 2Н2О) = 1,26 г | ||
Тестовые задания для самоконтроля
01. ВЫБЕРИТЕ ГРАФИК, СООТВЕТСТВУЮЩИЙ КРИВОЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ:
| 1) | 
| 3) | 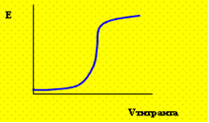
|
| 2) | 
| 4) | 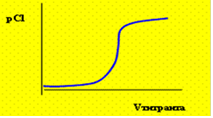
|
02.ПЕРМАНГАНАТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ ПРОВОДЯТ:
1) кислой среде
2) щелочной среде
3) нейтральной среде
4) любой среде
03. ПЕРМАНГАНАТОМЕТРИЯ ОТНОСИТСЯ К МЕТОДАМ:
1) нейтрализации
2) окисления-восстановления
3) осаждения
4) оксидиметрии
04. ВЫБЕРИТЕ ПРОДУКТЫ РЕАКЦИИ ТИТРОВАНИЯ РАСТВОРА НИТРИТА ПЕРМАНГАНАТОМ КАЛИЯ В КИСЛОЙ СРЕДЕ:
1) Mn2+ 2) MnO2 3) MnO42– 4) H2O 5) NO3– 6) NO2 7) NO
05. РАБОЧИМ ВЕЩЕСТВОМ В ПЕРМАНГАНАТОМЕТРИИ ЯВЛЯЕТСЯ:
1) H2SO4
2) I2
3) КBrO3
4) KMnO4
06. УКАЖИТЕ ФОРМУЛУ РАСЧЕТА МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА ПЕРМАНГАНАТА КАЛИЯ ПРИ ЕГО ВОССТАНОВЛЕНИИ В НЕЙТРАЛЬНОЙ СРЕДЕ:
1) 1/1 ∙ М(КМnO4)
2) 1/2 ∙ М(КМnO4)
3) 1/3 ∙ М(КМnO4)
4) 1/5 ∙ М(КМnO4)
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1412; Нарушение авторских прав?; Мы поможем в написании вашей работы!