
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Очень разб
|
|
|
|
 Активный
Активный 

 HNO3 + Me
HNO3 + Me 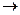
разб. Средней + Me (NO3)n + H2O
 активности
активности 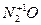
Малоактивный

+4

 NO
NO
+2
Средней
|
 активности NO2 + Me(NO3)n + H2O
активности NO2 + Me(NO3)n + H2O
конц.
Малоактивный
 NO2
NO2
Примеры:
1. Ba + HNO3 ® NH4NO3 + Ba(NO3)2 + H2O
очень разб.
1  NO
NO  + 10H+ + 8
+ 10H+ + 8 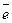 ® NH4+ + 3H2O
® NH4+ + 3H2O
4  Ba – 2
Ba – 2 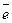 ® Ba2+
® Ba2+
NO  + 10H+ + 4Ba = NH4+ + 3H2O + 4Ba2+
+ 10H+ + 4Ba = NH4+ + 3H2O + 4Ba2+
4Ba + 10HNO3 = NH4NO3 + 4Ba(NO3)2 + 3H2O
2. Zn + HNO3 ® Zn(NO3)2 + N2O + H2O
разб.
 4 Zn – 2
4 Zn – 2 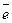 ® Zn2+
® Zn2+
 1 2NO
1 2NO  + 10H+ + 8
+ 10H+ + 8 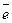 ® N2O + 5H2O
® N2O + 5H2O
4Zn + 2NO3- + 10H+ = 4Zn2+ + N2O + 5H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5H2O
Особенности взаимодействия металлов с концентрированной серной кислотой. Концентрированная серная кислота реагирует со всеми металлами, кроме Ag, Au, Pt. В концентрированной серной кислоте более сильным окислителем, чем катионы водорода, являются сульфат-ионы SO 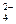 , поэтому при её взаимодействии с металлами Н2 не выделяется, а идёт восстановление серы S+6 в анионе SO
, поэтому при её взаимодействии с металлами Н2 не выделяется, а идёт восстановление серы S+6 в анионе SO 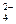 , при этом продукт восстановления зависит от активности металла:
, при этом продукт восстановления зависит от активности металла:

| Активный ® | H2S | |
  H2SO4(конц.) + Ме H2SO4(конц.) + Ме
| Ср. активности ® | S¯ | + Ме2(SO4)n + Н2О |
| Малоактивный ® | SO2 |
Например,
Zn + H2SO4 ® S + ZnSO4 + H2O
конц.
 3 Zn – 2
3 Zn – 2 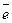 ® Zn2+
® Zn2+
 1 SO
1 SO 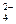 + 8H+ + 6
+ 8H+ + 6 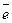 ® S + 4H2O
® S + 4H2O
3Zn + SO42- + 8H+ = 3Zn2+ + S + 4H2O
3Zn + 4H2SO4 = S + 3ZnSO4 + 4H2O
Примечание: в концентрированных растворах НNO3, Н2SO4 такие металлы как Fe, Al, Cr пассивируются образующимися оксидами.
Например,
Fe + HNO3 ® Fe2O3 + NO2 + H2O
конц.
Восстановительные свойства металлов по отношению к катионам металлов. В общем ионно-молекулярном виде такой тип взаимодействия можно представить следующим образом:
Ме1 + Ме2n+ ® Ме1m+ + Ме2
в-ль ок-ль пр. ок-ия пр. в-ния
Ме1 – m 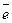 ® Ме1m+
® Ме1m+
Ме2n+ + n 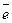 ® Ме2
® Ме2
Е0 = 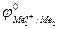 –
– 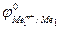
Так как самопроизвольному процессу отвечает Е0 > 0, то 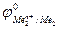 >
> 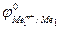 . Это означает, что более активный металл (с меньшим электродным потенциалом, Ме1) вытесняет менее активный металл (с большим электродным потенциалом, Ме2) из раствора его соли.
. Это означает, что более активный металл (с меньшим электродным потенциалом, Ме1) вытесняет менее активный металл (с большим электродным потенциалом, Ме2) из раствора его соли.
Например, реакция омеднения цинка в растворе сульфата меди (II) возможна, т.к. 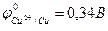 >
> 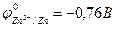 :
:
Zn + CuSO4 = ZnSO4 + Cu.
ЛИТЕРАТУРА
1. Ахметов Н.С. Общая и неорганическая химия. 4-е изд., испр – М.: Высшая школа, 2006. – 743 с.
2. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2009. – 727 с.
3. Коровин Н.В. Общая химия.. – М.: Высшая школа, 2007. – 556 с.
4. Лидин Р.А. Общая и неорганическая химия в вопросах Учебное пособие для ВУЗов. – М.: Изд-во Дрофа, 2005. – 230 с.
5. Лидин Р.А. Аликберова Л.Ю. Логинова Г.П. Общая и неорганическая химия в вопросах: Учеб пособие для вузов - 2-е изд перераб и доп. – М.: Изд-во Дрофа, 2004. – 216 с.
6. Хомченко И.Г. Общая химия. – М.: Новая волна, 2004. – 464 с.
Приложение 1
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 456; Нарушение авторских прав?; Мы поможем в написании вашей работы!