
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аккумуляторы
|
|
|
|
Аккумулятор представляет собой сосуд с электролитом, в который погружены два электрода — положительный и отрицательный. При пропускании через аккумулятор электрического тока, вырабатываемого посторонним источником, в аккумуляторе происходит превращение электрической энергии в химическую. Этот процесс называется зарядкой. При последующем замыкании клемм аккумулятора на цепь внешней нагрузки химическая энергия превращается в электрическую. Процесс получения электрической энергии от заряженного аккумулятора называется разрядкой.
В процессе зарядки э. д. с. аккумулятора повышается. В конце зарядки устанавливается определенная э. д. с., соответствующая заряженному аккумулятору. После этого прохождение зарядного тока уже не сопровождается накоплением энергии.
При разрядке аккумулятора э. д. с. на его зажимах падает. Разрядку аккумулятора прекращают, как только его э. д. с. достигает определенной величины, так как дальнейшая разрядка аккумулятора может вызвать его разрушение.
Количество электричества, которое может быть отдано предельно заряженным аккумулятором, называется его полезной емкостью. Полезная емкость определяется умножением величины получаемого от аккумулятора тока (в амперах) на время (в часах), в течение которого получали ток, и выражается формулой:
Q = Iptp.
В этой формуле: — емкость, выраженная в а-ч; Ip — сила получаемого от аккумулятора тока (его называют разрядным током) в а; p — время разрядки аккумулятора в час.
Емкость аккумулятора зависит от количества вещества, которое подвергается действию тока при зарядке, т. е. от размеров поверхности его пластин. Чем больше эта поверхность, тем больше емкость.
Однако емкость аккумулятора не является постоянной величиной и зависит от величины разрядного тока: при большем разрядном токе полезная емкость аккумулятора меньше, и, наоборот, при разрядке аккумулятора меньшими разрядными токами его полезная емкость оказывается больше.
Отношение
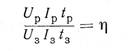
называется коэффициентом полезного действия (к. п. д.) аккумулятора. В этой формуле ир — напряжение, при котором происходит разрядка аккумулятора, a U3 — напряжение, при котором происходит зарядка аккумулятора.
Аккумулятор, предоставленный самому себе, постепенно разряжается. Это явление носит название саморазрядки аккумулятора.
Существуют два типа аккумуляторов, получивших широкое распространение: кислотные (свинцовые) и щелочные (железо- никелевые и кадмиево-никелевые).
Аккумулятор, электродами которого являются свинцовые пластины, а электролитом — раствор серной кислоты, называется свинцовым, или кислотным. Электродвижущая сила кислотного (свинцового) аккумулятора равняется в среднем 2 в; при зарядке аккумулятора она повышается до 2,5—2,7 в, по окончании зарядки быстро падает до 2,1 в, а при разрядке постепенно понижается до 1,8 в. Ниже последней величины разрядку не производят, так как, если ее продолжать, аккумулятор разрушается.
В процессе зарядки кислотного аккумулятора на его отрицательном электроде образуется слой чистого свинца, а на положительном — слой перекиси свинца. При разрядке обе пластины покрываются слоем окиси свинца.
В конце зарядки аккумулятора на отрицательной пластине собираются частицы водорода, а на положительной — кислорода, т. е. происходит разложение воды. Этот процесс называется кипением аккумулятора. Продолжение зарядки приводит только к бесполезной затрате энергии.
При зарядке аккумулятора поверхностный слой отрицательной пластины разрыхляется, становится пористым, или, как говорят, губчатым. Чем глубже происходит это разрыхление, т. е. чем толще слой губчатого свинца на отрицательной пластине и чем толще слой перекиси свинца на положительной, тем больше вещества активно участвует в химических реакциях, тем больше полезная емкость аккумулятора.
Однако образование этих слоев происходит медленно, поэтому новые аккумуляторы, прежде чем пустить в работу, подвергают нескольким длительным зарядкам и разрядкам для постепенного наращивания на пластинах достаточных по толщине слоев губчатого свинца и перекиси свинца. Этот процесс подготовки нового аккумулятора к эксплуатации называется формовкой.
Для увеличения емкости аккумуляторов в одном сосуде размещают несколько положительных и отрицательных пластин, чередуя их и располагая возможно ближе друг к другу. Крайние, т. е. ближайшие к стенке сосуда, пластины аккумулятора всегда отрицательные (в аккумуляторе отрицательных пластин на одну больше, чем положительных). Все положительные пластины припаиваются своими верхними отростками к свинцовой полосе, расположенной по одну сторону аккумулятора, а все отрицательные — к свинцовой полосе, расположенной по другую сторону аккумулятора. Эти две свинцовые полосы являются, таким образом, положительным и отрицательным полюсами аккумулятора. Чтобы соседние пластины не могли касаться друг друга, т. е. чтобы устранить опасность короткого замыкания в аккумуляторе, между пластинами помещают изолирующие прокладки (например, тонкие эбонитовые листы), называемые сепараторами (отделителями). Сосуды аккумуляторов изготавливают из стекла, эбонита или целлулоида, а иногда из дерева, причем в последнем случае сосуд обкладывают внутри свинцом, чтобы предохранить дерево от разъедания кислотой.
Необходимая крепость наливаемого в сосуд раствора серной кислоты характеризуется удельным весом электролита. Требуемый удельный вес электролита указывается обычно в инструкции, прилагаемой к аккумулятору заводом-изготовителем. В результате протекающих в аккумуляторе химических реакций удельный вес электролита при зарядке увеличивается, а при разрядке уменьшается.
Так как электродвижущая сила кислотного аккумулятора равна только 2 в, то для получения более высокого напряжения аккумуляторы соединяют последовательно друг с другом.
Последовательно соединенные аккумуляторы образуют аккумуляторную батарею.
Такая батарея из трех последовательно соединенных аккумуляторов представлена на рис. 1.
Кислотные аккумуляторы на судах в основном употребляются как стартерные для запуска судовых вспомогательных дизелей.
Наряду с кислотными в настоящее время применяются два типа щелочных аккумуляторов, отличающихся друг от друга составом активной массы отрицательных пластин: у аккумуляторов одного типа эта масса — губчатое железо, у аккумуляторов другого типа — губчатый кадмий с губчатым железом. Положительными пластинами заряженных щелочных аккумуляторов является гидрат окиси никеля. Электролитом служит водный раствор едкого калия или натрия.
При разрядке (под нагрузкой) напряжение щелочного аккумулятора падает от 1,78—1,83 до 1,25—1,15 В.
Щелочные аккумуляторы обладают значительной механической прочностью, не боятся тряски, вибраций, выгодно отличаются от кислотных меньшим весом при одинаковой емкости, весьма незначительным саморазрядом. Они не разрушаются при переразрядке и даже при полной разрядке и обладают более длительным сроком службы. Однако к. п. д. и отдача щелочных аккумуляторов, а также напряжение их значительно ниже кислотных, при этом стоимость щелочных аккумуляторов в два раза больше стоимости кислотных.
Положительные качества щелочных аккумуляторов обусловливают их широкое применение на морских судах для питания радиоприемных устройств, цепей связи и сигнализации.
Каждая аккумуляторная батарея имеет условное обозначение, состоящее из цифр и букв.
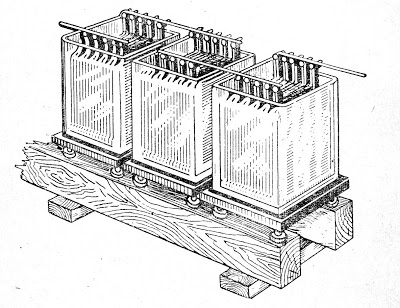
Рис. 1
В начале обозначения стоит цифра, показывающая число последовательно соединенных элементов. Следующие за цифрой буквы в, основном определяют назначение и материал банок батареи, а число, стоящее в конце обозначения, — емкость батареи в ампер- часах.
Так, в обозначении кислотной батареи 6СТЭ-128: 6 — это шесть последовательно соединенных элементов; СТ — назначение батареи (стартерная для стартерного запуска дизеля); Э — материал банок — эбонит (в некоторых типах может быть П — пластмасса); 128 — емкость батареи (128 а-ч).
Обозначение щелочного аккумулятора 10НКН-45 расшифровывается следующим образом: 10 — число последовательно соединенных банок; Н — накальная — для питания цепей накала радиоламп; КН — кадмиево-никелевая; 45 — емкость батареи (45 А×ч).
У щелочных батарей вместо НКН может стоять НЖН (для железо-никелевых аккумуляторов).
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 793; Нарушение авторских прав?; Мы поможем в написании вашей работы!