
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В обменных реакциях эквивалентное число по величине равно суммарному заряду замещающихся (обменивающихся) ионов в одной формульной единице данного вещества
|
|
|
|
Расчет Z(В) в обменных реакциях.
Расчет Z(В) в окислительно-восстановительных реакциях.
В окислительно-восстановительных реакциях имеет место изменение степеней окисления атомов в результате отдачи или принятия электронов. В таких реакциях Z(В) определяют по числу отданных электронов одной формульной единицей восстановителя или принятых электронов одной формульной единицей окислителя.
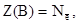 (2)
(2)
где 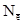 – число отданных или принятых электронов одной формульной единицей вещества.
– число отданных или принятых электронов одной формульной единицей вещества.
Например, в реакции
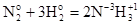 (3)
(3)
Z(N2) = 6, т.к. одна формульная единица азота N2 принимает в ходе реакции шесть электронов:
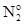 + 6
+ 6 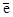 = 2N-3
= 2N-3 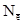 = 6, (4)
= 6, (4)
а Z(H2) = 2, т.к. одна формульная единица водорода H2 отдает два электрона:
 , (5)
, (5)
На примере реакций (6) и (8) можно убедиться, что одно и то же вещество – углерод может иметь различные значения Z(В).
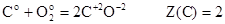 (6)
(6)
т.к. 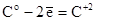
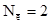 (7)
(7)
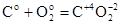 Z(C) = 4 (8)
Z(C) = 4 (8)
т.к. 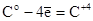
 (9)
(9)
Как следует из приведенных реакций (6) и (8) эквивалентное число кислорода равно четырём, Z(O2) = 4, т.к. одна формульная единица O2 принимает четыре электрона:
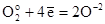
 (10)
(10)
В реакциях обмена степени окисления атомов не изменяются и каждый из ионов сохраняет свой заряд. В таких реакциях происходит замещение одних ионов на другие.
Например, в реакции
H3PO4 + 2KOH = K2HPO4 + 2H2O (11)
в одной формульной единице H3PO4 заместилось два иона водорода, т.к. продуктом замещения является K2HPO4.
Z(В) = Ni · |qi|, (12)
где Ni – число заместившихся ионов в одной ФЕ вещества;
|qi| - абсолютное значение заряда заместившихся ионов.
Так в реакции (11) в H3PO4 замещается водород, для которого 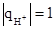 , а Z(H3PO4) = 2∙1=2, т.к. заместилось два атома водорода.
, а Z(H3PO4) = 2∙1=2, т.к. заместилось два атома водорода.
Рассчитаем эквивалентные числа карбоната натрия Na2CO3 в реакциях (13) и (15).
В реакции
Na2CO3 + HCl = NaHCO3 + NaCl (13)
Z(Na2CO3) = 1, т.к. в одной формульной единице Na2CO3 замещается один ион натрия, заряд которого равен +1.
Z(Na2CO3) = 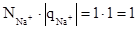 (14)
(14)
В реакции
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O (15)
Z(Na2CO3) = 2, т.к. в одной формульной единице Na2CO3 замещаются два иона натрия, суммарный заряд которых по величине равен двум
Z(Na2CO3) = 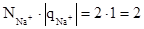 (16)
(16)
Таким образом, в реакциях (13) и (15) карбонат натрия имеет разные значения Z(Na2CO3).
Расчет Z(В) в обменных реакциях можно вести как по положительной так и по отрицательной части молекулы сложного вещества, что показано на примере реакции (17) (см. табл. 3).

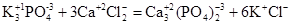 (17)
(17)
Таблица 3
| ФЕ | Замещающиеся частицы | Ni | qi | Z(B) | Э(В) |
| K3PO4 | K+ | +1 | 3·1=3 | 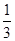 K3PO4 K3PO4 
| |
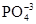
| –3 | 1·3=3 | |||
| CaCl2 | Ca+2 | +2 | 1·2=2 |   CaCl2 CaCl2
| |
| Cl– | –1 | 2·1=2 | |||
| Ca3(PO4)2 | Ca+2 | +2 | 3·2=6 | 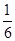 Ca3(PO4)2 Ca3(PO4)2
| |
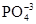
| –3 | 2·3=6 | |||
| KCl | K+ | +1 | 1·1=1 | KCl | |
| Cl– | –1 | 1·1=1 |
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1190; Нарушение авторских прав?; Мы поможем в написании вашей работы!