
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные свойства альдегидов и кетонов: реакции альдольной и кротоновой конденсации, окисление альдегидов, кетонов, биологическое окисление
|
|
|
|
Взаимодействие альдегидов а) со спиртами (образование ацеталей и полуацеталей); б) с водой; в) с аммиаком, аминами (образование иминов-оснований Шиффа); г) с циановодородной кислотой.
Тип гибридизации атомных орбиталей карбонильного атома углерода. Распределение электронной плотности в молекулах. Реакционные центры альдегидов и кетонов: электрофильный, основный, СН-кислотный.
• электрофильный центр - атом углерода карбонильной группы - предопределяет возможность нуклеофильной атаки;
• основный центр - атом кислорода - обусловливает возможность атаки протоном;
• СН-кислотный центр, атом водорода которого обладает слабой протонной подвижностью и может, в частности, подвергаться атаке сильным основанием.
9. Реакции нуклеофильного присоединения АN-типичные реакции альдегидов и кетонов. Сопоставление реакционной способности в реакциях АN: а) в гомологическом ряду альдегидов; б) в гомологическом ряду кетонов; г) кетонов и альдегидов.
Реакции нуклеофильного присоединения АN являются наиболее характерными реакциями для карбонильных соединений. Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от величины частичного
положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды. С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина частичного положительного заряда δ+ на нем в альдегидах и кетонах убывает в следующем ряду:
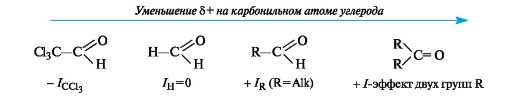
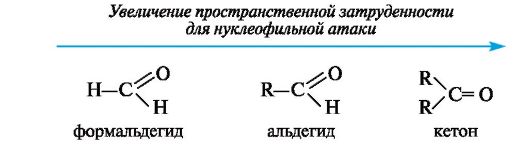
Пространственная доступность карбонильного атома углерода уменьшается при замене водорода более объемистыми органическими радикалами, поэтому альдегиды более реакционноспособны, чем кетоны. Исходя из этого, реакционная способность альдегидов и кетонов уменьшается при увеличении радикала.
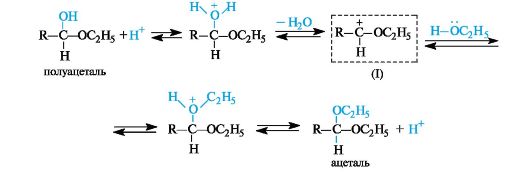
Присоединение спиртов. Спирты при взаимодействии с альдегидами легко образуют полуацетали. Полуацетали обычно не выделяют из-за их неустойчивости. При избытке спирта в кислой среде полуацетали превращаются в ацетали

Присоединение воды. Присоединение воды к карбонильной группе - гидратация - обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата.

Присоединение аминов и их производных. Амины и другие азотсодержащие соединения общей формулы NH2X (X = R, NHR) реагируют с альдегидами и кетонами в две стадии. Сначала образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. В связи с этим данный процесс в целом классифицируют как реакцию присоединения-отщепления.

В случае первичных аминов получаются замещенные имины (их называют также основаниями Шиффа).

Конденсацией называют реакцию, приводящую к возникновению новой углерод-углеродной связи, причем из двух или нескольких относительно простых молекул образуется новая, более сложная молекула.
Продукт реакции, содержащий гидроксильную и альдегидную группы, называется альдолем (от слов альдегид и алкоголь), а сама реакция получила название альдольной конденсации, или альдольного присоединения.
Механизм альдольной конденсации
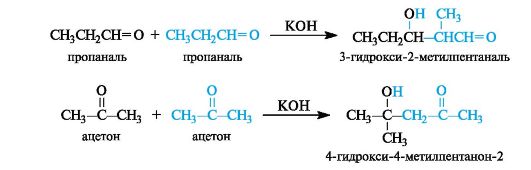
Продукт конденсации - альдоль - способен к отщеплению воды с образованием α,β-ненасыщенного карбонильного соединения. Обычно это происходит при повышенной температуре. В этом случае реакция в целом называется кротоновой конденсацией.

Окисление альдегидов в карбоновые кислоты осуществляется под действием большинства окислителей, включая кислород воздуха. Кетоны в мягких условиях не окисляются.

Оксид серебра в виде аммиачного комплекса [Ag(NH3]2OH (реактив Толленса) окисляет альдегиды в карбоновые кислоты, при этом выделяется металлическое серебро. Отсюда происходит название - реакция «серебряного зеркала».
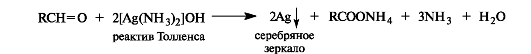
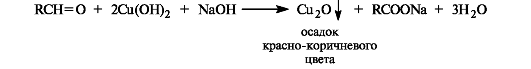
Так же легко альдегиды окисляются гидроксидом меди(II) в щелочной среде.
12. Карбоновые кислоты: строение, классификация. Тип гибридизации атомных орбиталей карбоксильного атома углерода. Электронное строение карбоновых кислот: р,п-сопряжение, +М-эффект ОН-группы, +I-эффект бокового радикала.
Карбоновые кислоты благодаря карбоксильной группе полярны и могут участвовать в образовании межмолекулярных водородных связей (см. 2.2.3). Такими связями с молекулами воды объясняется неограниченная растворимость низших кислот (C1-C4). В молекулах карбоновых кислот можно выделить гидрофильную часть (карбоксильную группу СООН) и гидрофобную часть (органический радикал R). По мере возрастания доли гидрофобной части снижается растворимость в воде.
В зависимости от природы органического радикала карбоновые кислоты могут быть алифатическими (насыщенными или ненасыщенными) RCOOH и ароматическими ArCOOH. По числу карбоксильных групп они подразделяются на монокарбоновые, дикарбоновые и трикарбоновые.

Карбон карбоксильной группы находится в состоянии sp2-гибридизации, угол O-C-O в различных кислотах составляет 118-122,5°
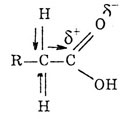
П-электроны взаимодействуют с р-электронами кислорода гидро-ксигруппы, а это приводит к сопряжению. Поляризация связи С=0 резко возрастает за счет дополнительного стягивания неподеленной пары электронов (р-электронов) атома кислорода ОН-группы. Вследствие такого смещения электронной плотности связь О—Н в гид-роксигруппе ослабляется, и атом водорода легко отщепляется в виде иона Н-. Поэтому именно гидроксигруппа участвует почти во всех реакциях: она или замещается, или диссоциирует по кислотному типу.
В карбоксилат-ионе происходит перераспределение электронной плотности между двумя атомами кислорода и углеродом. В результате двойная связь практически отсутствует в растворах кислот:

Так как влияние атомов взаимно, карбоксильная группа оказывает влияние на радикал. В результате этого атомы водорода соседнего с функциональной группой отличаются большей подвижностью от других атомов водорода радикала и могут замещаться.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 2113; Нарушение авторских прав?; Мы поможем в написании вашей работы!