
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гетерофункциональные органические соединения (кетокислоты, гидроксикислоты, аминокислоты, аминофенолы, аминоспирты. Привести примеры.
|
|
|
|
Двухосновные карбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Оксалаты. Декарбоксилирование щавелевой и малоновой кислот. Превращение янтарной кислоты в фумаровую. Биологическое значение.
| Название кислоты | Формула | Название аниона или основы сложного эфира |
| Щавелевая (этандиовая) Малоновая (пропандиовая) Янтарная (бутандиовая) Глутаровая (пентандиовая) | НООС-СООН НООССН2СООН НООС(СН2)2СООН НООС(СН2)3СООН | Оксалат Малонат Сукцинат Глутарат |
Щавелевая кислота - простейшая двухосновная кислота. Некоторые ее соли, например оксалат кальция, трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни).
Янтарная кислота в заметном количестве была обнаружена в янтаре, откуда получила название сама кислота и ее производные сукцинаты (от лат. succinium - янтарь).
Малеиновая и фумаровая кислоты - представители ненасыщенных дикарбоновых кислот с одной двойной связью. Фумаровая кислота участвует в обменных процессах, протекающих в организме.

Кислотные свойства. С накоплением кислотных групп увеличиваются кислотные свойства соединений. Кислотность дикарбоновых кислот больше, чем монокарбоновых. Так, щавелевая кислота (pKa 1,23) значительно сильнее уксусной (pKa 4,76), что связано с -/- эффектом группы СООН, и благодаря этому более полной делокализации отрицательного заряда в сопряженном основании.
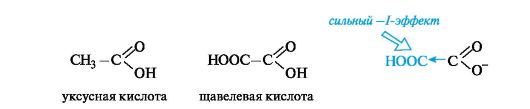
Влияние заместителя наиболее отчетливо проявляется при его близком расположении к кислотному центру.
Декарбоксилирование. При нагревании с серной кислотой щавелевая кислота декарбоксилируется, а образовавшаяся муравьиная кислота разлагается далее.

Малоновая кислота легко декарбоксилируется при нагревании выше 100?С

Малеиновая и фумаровая кислоты проявляют сходные химические свойства: вступают в реакции, свойственные соединениям с двойной связью (обесцвечивание бромной воды, водного раствора перманганата калия) и соединениям с карбоксильными группами (образуют два ряда производных - кислые и средние соли, эфиры и т. п.). Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную циклизацию с образованием циклического ангидрида. В фумаровой кислоте вследствие удаленности карбоксильных групп друг от друга в пространстве образование циклического ангидрида невозможно.
Окисление янтарной кислоты in vivo. Дегидрирование (окисление) янтарной кислоты в фумаровую, катализируемое в организме ферментом, осуществляется с участием кофермента ФАД. Реакция протекает стереоспецифично с образованием фумаровой кислоты (в ионной форме - фумарат).

Сукцинатдегидрогеназа (КФ 1.3.99.2) катализирует превращение янтарной кислоты в фумаровую. Кофактором фермента является ФАД. Фермент прочно связан с внутренней мембраной митохондрий.
Малоновая кислота в малых концентрациях (0 01 М) является высокоспецифичным ингибитором одной из стадий постулированной схемы реакций, а именно стадии превращения янтарной кислоты в фумаровую. Введение малоновой кислоты в дышащую дыхательную систему приводит к уничтожению отмеченного каталитического эффекта и накоплению янтарной кислоты
Гетерофункциональными называют соединения, в молекулах которых имеются различные функциональные группы.
Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксигруппы.
Эти две функциональные группы непрочно удерживаются у одного атома углерода, в результате чего происходит отщепление аммиака или воды. Простейшим представителем аминоспиртов является 2-аминоэтанол - соединение, в котором обе группы расположены у соседних атомов углерода. 2-Аминоэтанол (тривиальное название коламин) является структурным компонентом сложных липидов - фосфатидилэтаноламинов (см. 10.4.1).
С сильными кислотами 2-аминоэтанол образует устойчивые соли.

Важная роль в организме принадлежит аминоспиртам, содержащим в качестве структурного фрагмента остаток пирокатехина. Они носят общее название катехоламинов. К этой группе относятся представители образующихся в организме биогенных аминов. К катехоламинам принадлежат дофамин, норадреналин и адреналин, выполняющие, как и ацетилхолин, роль нейромедиаторов. Адреналин участвует в регуляции сердечной деятельности, при физиологических стрессах он выделяется в кровь («гормон страха»).
Гидроксикислотами называют соединения, содержащие в молекуле одновременно гидроксильную и карбоксильную группы. Аминокислоты содержат в молекуле аминогруппу и карбоксильную группу.
В алифатическом ряду по взаимному расположению функциональных групп различают α-, β-, γ- и т. д. гидрокси- и аминокислоты. Буквой греческого алфавита указывают положение другой функциональной группы относительно карбоксильной, при этом отсчет ведется от ближайшего к карбоксильной группе атома углерода, т. е. от атома С-2. Отметим, что в заместительной номенклатуре для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются.
Кислотно-основные свойства. В гетерофункциональных соединениях в зависимости от природы функциональных групп и их местоположения в молекуле возможно усиление или, наоборот, ослабление некоторых свойств, характерных для монофункциональных соединений. Например, кислотность гидроксикислот выше, чем незамещенных кислот. Аминокислоты, содержащие одновременно кислотные и основные фунциональные группы, проявляют амфотерные свойства, т. е. способность взаимодействовать как с кислотами, так и с основаниями. В нейтральных водных растворах или кристаллическом состоянии аминокислоты существуют преимущественно в форме внутренних солей (диполярных ионов), как показано на примере γ-аминомасляной кислоты.

α-Гидрокси- и α-аминокислоты. У α-гидроксикислот и α-аминокислот функциональные группы близки, но внутримолекулярного взаимодействия между ними не происходит из-за неустойчивости трехчленных циклов, которые могли бы при этом образоваться. При нагревании α-гидрокси- и α-аминокислоты претерпевают межмоле- кулярную циклизацию с образованием продуктов, называемых соответственно лактидами и дикетопиперазинами (последнее - от названия шестичленного гетероцикла с двумя атомами азота - пиразина).
Лактиды содержат две сложноэфирные группы, дикетопиперазины - две амидные группы.
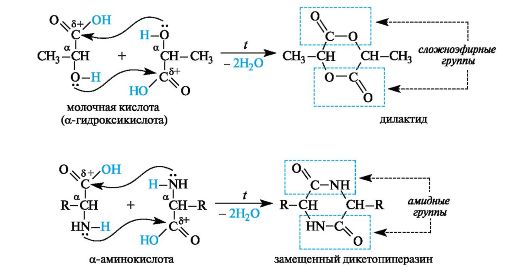
Лактиды и дикетопиперазины, являясь сложными эфирами или амидами соответственно, в условиях кислотного или основного ката- лиза способны гидролизоваться с образованием исходных α-гидрокси- или α-аминокислот.
Особое свойство α-гидроксикислот заключается в их способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты.

Молочная кислота известна как продукт молочнокислого брожения лактозы, содержащейся в молоке, и других углеводов, входящих в состав овощей и плодов.
В организме L-(+)-молочная кислота является одним из продуктов превращения глюкозы (гликолиза). Она накапливается в мыш- цах при интенсивной работе, вследствие чего в них возникает характерная боль. Причина накопления молочной кислоты - недостаток
кислорода, что вызывает восстановление пировиноградной кислоты с участием НАДН в молочную.
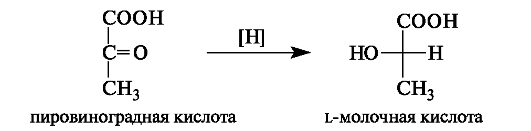
Во время отдыха запасы кислорода возобновляются, и молочная кислота окисляется снова в пировиноградную кислоту.
Яблочная кислота в значительных количествах содержится в незрелых яблоках, рябине, фруктовых соках. В организме l-яблочная кислота образуется путем гидратации фумаровой кислоты.

Лимонная кислота содержится в плодах цитрусовых (лимоны, апельсины), винограде, крыжовнике, а также в листьях табака.
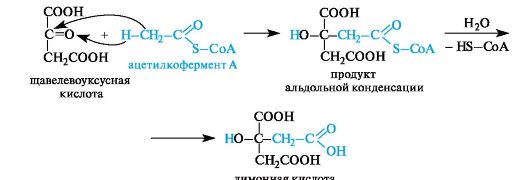
Биосинтез лимонной кислоты происходит по типу альдольной конденсации из щавелевоуксусной кислоты и ацетилкофермента А
Оксокислотами называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы.
В соответствии с этим различают альдегидокислоты и кетонокислоты.
Важную роль в биохимических процессах играют кетонокислоты - пировиноградная, ацетоуксусная и щавелевоуксусная
Пировиноградная кислота является одним из промежуточных продуктов молочнокислого и спиртового брожения углеводов. Своим названием пировиноградная кислота обязана тому, что впервые была выделена при пиролизе виноградной кислоты.
Пировиноградная кислота декарбоксилируется при нагревании с разбавленной и декарбонилируется (отщепляет СО) - с концент- рированной серной кислотой

Щавелевоуксусная кислота одновременно является α- и β-оксокислотой. Она образуется при окислении яблочной кислоты.
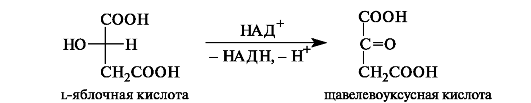
Бензойная кислота. Применяется в виде натриевой соли как отхаркивающее средство. В свободном виде бензойная кислота встречается в некоторых смолах и бальзамах, а также в клюкве, бруснике, но чаще
содержится в связанном виде, например в виде N-бензоильного производного аминоуксусной кислоты, называемого гиппуровой кислотой. Эта кислота образуется в печени из бензойной и аминоуксусной (глицин) кислот и выводится с мочой. В клинической практике по количеству гиппуровой кислоты в моче больных (после приема бензоата натрия) судят об эффективности обезвреживающей функции печени.

и-Аминофенол и его производные. Как гетерофункциональное соединение п-аминофенол может образовывать производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. Сам п-аминофенол ядовит; интерес для медицины представляет его производное - парацетамол, оказывающий анальгетическое (обезболивающее) и жаропонижающее действие.

Салициловая кислота и ее производные. Салициловая кислота (см. 8.1) относится к группе фенолокислот. Как соединение с орто- расположением функциональных групп она декарбоксилируется при нагревании с образованием фенола.
Салициловая кислота умеренно растворима в воде, дает интенсивное окрашивание с хлоридом железа(Ш), на чем основано качественное обнаружение фенольной гидроксильной группы. Салициловая кислота проявляет антиревматическое, жаропонижающее и антигрибковое действие, но как сильная кислота (рKа 3,0) вызывает раздражение желудочно-кишечного тракта и поэтому применяется только наружно. Внутрь применяют ее производные - соли или эфиры.
Салициловая кислота способна образовывать производные по каждой функциональной группе. Практическое значение имеют салицилат натрия, сложные эфиры по карбоксильной группе - метилсалицилат, фенилсалицилат (салол), а также по гидроксильной группе - ацетилсалициловая кислота (аспирин)

17. α-Аминокислоты. Строение, классификация α-Аминокислот по природе радикала: алифатические, ароматические, гетероциклические. Заменимые и незаменимые α-Аминокислоты. Привести примеры.
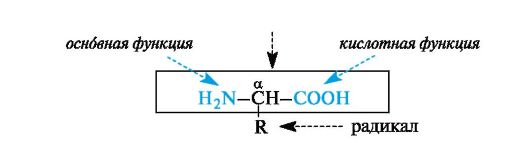
α-Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.

Многие α-аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми
К незаменимым α-аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонин фенилаланин
Алифатические α-аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
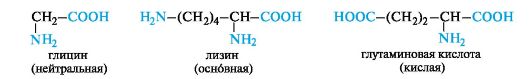
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
• нейтральные аминокислоты - по одной группе NH2 и СООН;
• основные аминокислоты - две группы NH2 и одна группа
СООН;
• кислые аминокислоты - одна группа NH2 и две группы СООН.
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
• гидроксильная - серин, треонин;
• карбоксильная - аспарагиновая и глутаминовая кислоты;
• тиольная - цистеин;
• амидная - аспарагин, глутамин.
Ароматические α-аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН2-.
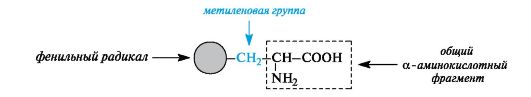
Гетероциклические α-аминокислоты. Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Строение и свойства этих гетероциклов рассмотрены ниже (см. 13.3.1; 13.3.2). Общий принцип построения гетероциклических аминокислот такой же, как и ароматических.
Гетероциклические и ароматические α-аминокислоты можно рассматривать как β-замещенные производные аланина.

К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового

18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 5186; Нарушение авторских прав?; Мы поможем в написании вашей работы!