
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальна характеристика оксокислот
|
|
|
|
ОКСОКИСЛОТИ
(На самостійне опрацювання)
План лекції:
1. Загальна характеристика оксокислот.
2. Природні джерела та способи добування оксокислот.
3. Хімічні властивості кислот.
4. Окремі представники оксикислот та їх використання.
Ключові слова: оксикислота, гетерофункціональні сполуки, альдегідокислоти, кетокислоти, гліоксилова кислота, піровиноградна кислота, ацетооцтовий естер, кето-енольна таутомерія, декарбонілування.
Література: [2] с. 5 – 12; [3] с. 432 – 441
Сполуки, до складу молекул яких поряд із карбоксильною групою  входить карбонільна
входить карбонільна  , називаються оксокислотами або альдегідокислотами і кетокислотами. Це гетерофункціональні сполуки, вони містять дві функціональні групи (
, називаються оксокислотами або альдегідокислотами і кетокислотами. Це гетерофункціональні сполуки, вони містять дві функціональні групи ( і
і  ).
).
Для назв оксокислот часто використовують тривіальні назви: піровиноградна, ацетооцтова та інші.
Номенклатура оксокислот
| Формула | Номенклатура | ||
| Систематична IUPAC | Раціональна | Тривіальна | |
| Альдегідокислоти | |||

| 2-Оксоетанова | Формілмурашина | Гліоксилова |

| 3-Оксопропанова | Формілоцтова | Малональдегідна |
| Кетокислоти | |||

| 2-Оксопропанова | a -Кетопропіонова | Піровиноградна |

| 3-Оксобутанова | b -Кетобутиратна | Ацетооцтова |
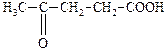
| 4-Оксопентанова | g -Кетовалер’янова | Левулінова |
За номенклатурою ІUPAС головний ланцюг, який містить обидві функціональні групи, нумерується, починаючи з карбоксильної групи. Положення альдегідної або кетонної групи позначається відповідною цифрою з додаванням префікса «оксо-».
Наприклад:

| 
|
| 4-оксобутанова кислота | 3-оксобутанова кислота |
Раціональні назви будують від назв відповідних кислот із позначенням положення оксогрупи; атом Карбону, який безпосередньо зв’язаний із карбоксилом, позначається літерою a -, наступний b -, далі g - і т. і.
3. Природні джерела та способи добування оксокислот
Найпоширеніші способи добування: окиснення оксикислот; окиснення гліколів; гідроліз гемінальних дигалогензаміщених кислот; гідроліз оксонітрилів.
Наприклад, під час окиснення молочної килоти утворюється піровиноградна:

Гліоксилова кислота утворюється в результаті окиснення етиленгліколю:

4. Хімічні властивості
Оксокислоти виявляють хімічні властивості, що обумовлені наявністю двох функціональних груп. І кислотні властивості, і властивості альдегідів або кетонів в оксокислотах більш виражені за рахунок взаємного впливу двох функціональних груп:
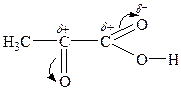
Найактивніші — a -оксокислоти. Їм характерні усі реакції карбоксильної групи: утворення солей, галогенангідридів, естерів, амідів та ін. Реакції за оксогрупою: реакція “срібного дзеркала”, утворення оксимів, фенілгідразонів, оксинітрилів, бісульфітних похідних тощо.
Типовими реакціями a -кетокислот є їх декарбоксилування під дією розведеної сульфатної кислоти за умов слабкого нагрівання та декарбонілування за умов нагрівання з концентрованою сульфатною кислотою:

|
5. Окремі представники оксокислот та їх використання
Гліоксилова кислота поширена у природі, особливо у великій кількості вона міститься у недозрілих фруктах, а також у соку цукрового буряка. Гліоксилова кислота відіграє важливу роль у обмінних процесах у рослин і мікроорганізмів.
Піровиноградна кислоа широко розповсюджена у природі, є проміжним продуктом процесів молочнокислого і спиртового бродіння, окиснення вуглеводів в організмі. Вона утворюється за умов нагрівання (піролізу) виноградної кислоти, звідси її тривіальна назва — піровиноградна кислота:

|
Ацетооцтова кислота утворюється за рахунок β-окиснення жирних кислот при метаболізмі. Кислота дуже нестійка і легко декарбоксилується з утворенням ацетону. Солі, естери та інші похідні ацетооцтової кислоти досить стійкі.
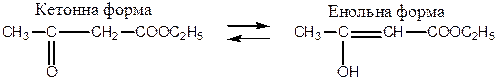
Ацетооцтовий естер відіграє важливу роль у теоретичній органічній хімії й органічному синтезі. Для ацетооцтового естеру характерне явище таутомерії - рухомої динамічної ізомерії. Одна з ізомерних форм естеру мітить кетогрупу (кетоформа), друга – гідроксильну групу (енольна форма).
Кето-енольна таутомерія ацетооцтового естеру:
|
У хімічному відношенні ацетооцтовий естер реакційно здатний як за кетонною, так і за енольною формами. Реакції кетонної форми: відновлення воднем, приєднання  ,
,  , взаємодія з гідроксиламіном, фенілгідразином. Реакції енольної форми: взаємодія з розчином ферум(ІІІ) хлориду (якісна реакція), реакція приєднання
, взаємодія з гідроксиламіном, фенілгідразином. Реакції енольної форми: взаємодія з розчином ферум(ІІІ) хлориду (якісна реакція), реакція приєднання 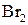 за місцем подвійного зв’язку, утворення натрій ацетооцтового естеру.
за місцем подвійного зв’язку, утворення натрій ацетооцтового естеру.
ГІДРОКСИКИСЛОТИ
Лекція №15 (2 години)
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 4421; Нарушение авторских прав?; Мы поможем в написании вашей работы!