
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова та класифікація білків
|
|
|
|
Знаходження в природі. Функції білків в організмі людини
Білки широко розповсюджені у природі, входять до складу всіх живих організмів. Білки – найважливіші біологічні сполуки і основні споживчі речовини.
Функції білків: каталітична (білки – ферменти, під дією яких прискорюються і регулюються усі хімічні перетворення в живих організмах); структурна (білки беруть участь у побудові мембран усіх клітин, входять до складу з’єднувальних і кісткових тканин - колаген, волосся, нігтів, шкіри - кератин); скорочувальна (робота м'язів, рух протоплазми в клітині і ін.) енергетична (при окисненні 1г білку утворюється приблизно 4,0 ккал енергії); регуляторна (білки входять до складу різних біологічно активних речовин: гормонів; медіаторів, які виділяються в області нервових закінчень, та ін.); рецепторна (білки – рецептори клітинної мембрани після зв’язування певних сполук передають інформацію в середину клітини і іншим клітинам: на такому принципі базується органолептика); гомеостатична (білки забезпечують сталість внутрішнього середовища організму (гомеостаз), так як вони мають амфотерні властивості і є частиною буферних систем крові); транспортна (білки переносять багато речовин через клітинні мембрани: так, наприклад, альбуміни транспортують ліпіди, вітаміни, йони металів, гормони, гемоглобін переносить кисень по крові від легень до тканин і органів); захисна (білки захищають організм проти впливу шкідливих для життєдіяльності факторів - антитіла).
Елементарний аналіз різних білків свідчить, що складовими елементами всіх білків є наступні п’ять:
| C — 50…55% H — 6,6…7,3% O — 21,5…23,5% | N — 15…17% S — 0,2…2,5% |
Через присутність різноманітних функціональних груп білки не можна віднести до якогось певного класу органічних сполук. За хімічним складом білки поділяють на дві групи — прості та складні. За фізіологічними функціями — фібрилярні та глобулярні білки. Із фібрилярних блків побудовані волокна живих тканин. До них відносяться кератин (шкіра, волосся, нігті, роги, пір’я, м’язи). Глобулярні білки підтримують і регулюють життєві процеси. До них належать усі ферменти, гемоглобін — носій кисню у крові, багато гормонів, зокрема інсулін підшлункової залози.
Білки мають тривіальні назви, наприклад, гемоглобін, рибонуклеаза, фібриноген та інші.
Будова молекул. Складність виділення. Гіпотеза О.Я. Данилевського (1888 р.) — амінокислоти в білках зв’язані амідним зв’язком  , який отримав назву пептидного зв’язку. Трохи пізніше Гофмейстер і Е. Фішер експериментально підтвердили цю гіпотезу. Перший білок, будова якого була розшифрована – гормон інсулін (Фромажо і Сейнгер) –
, який отримав назву пептидного зв’язку. Трохи пізніше Гофмейстер і Е. Фішер експериментально підтвердили цю гіпотезу. Перший білок, будова якого була розшифрована – гормон інсулін (Фромажо і Сейнгер) –  . Було встановлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, які зв’язані дисульфідними містками. Усього в інсуліні 51
. Було встановлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, які зв’язані дисульфідними містками. Усього в інсуліні 51 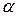 -амінокислота, поліпептидні ланцюги складаються з 21 і 30
-амінокислота, поліпептидні ланцюги складаються з 21 і 30 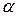 -амінокислот.
-амінокислот.
Кожна білкова молекула має певну будову, яка визначається послідовністю розташування амінокислот у поліпептидних ланцюгах, характерним розміщенням цих ланцюгів у просторі, здатністю створювати молекулярні структури у вигляді глобул або фібрил. Для зручності вивчення будови молекул білка, їх розташування в просторі визначають різні рівні структури білкової молекули: первинну, вторинну, третинну і четвертинну.
Первинна структура — це певна послідовність амінокислот у молекулах білків, сполучених між собою ковалентними пептидними зв'язками. Первинна структура стабілізується також дисульфідними зв'язками, якщо вони є в білковій молекулі.
Вторинна структура кожної білкової молекули характеризується просторовим розміщенням поліпептидного ланцюга (конформацією молекули). Вторинна структура обумовлена утворенням водневих зв’язків між полярними пептидними групами  .
.
На основі рентгеноструктурних досліджень поліпептидів і білків Л. Полінг і Р. Корі встановили, що в складі природних глобулярних білків поліпептидні ланцюги можуть утворювати 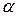 -спіраль, в якій на один виток припадає 3,6 залишку амінокислоти. Крок спіралі — відстань між витками — дорівнює 0,54 нм, кут підйому витка — 26°, висота одного залишку амінокислоти становить 0,15 нм. Радикали залишків амінокислот знаходяться на поверхні спіралі.
-спіраль, в якій на один виток припадає 3,6 залишку амінокислоти. Крок спіралі — відстань між витками — дорівнює 0,54 нм, кут підйому витка — 26°, висота одного залишку амінокислоти становить 0,15 нм. Радикали залишків амінокислот знаходяться на поверхні спіралі.
Ступінь спіралізації поліпептидних ланцюгів білка залежить від його первинної структури. Так, молекули гемоглобіну і міоглобіну спіралізовані на 75 %, альбуміну сироватки крові — на 50 %, пепсину — на 28 %.
Крім 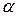 -спіралі поліпептидний ланцюг може формувати іншу впорядковану конформацію, яка дістала назву β -структури, або складчастого шару. β -Структура утворюється поліпептидними ланцюгами, які розміщені паралельно і сполучаються між собою за рахунок водневих зв'язків між поліпептидними групами, розміщеними поруч.
-спіралі поліпептидний ланцюг може формувати іншу впорядковану конформацію, яка дістала назву β -структури, або складчастого шару. β -Структура утворюється поліпептидними ланцюгами, які розміщені паралельно і сполучаються між собою за рахунок водневих зв'язків між поліпептидними групами, розміщеними поруч.
β-Структура найбільш поширена в білках опорних тканин — колагені (білок сполучної тканини, сухожилля, шкіри), фіброїні (білок шовку), кератині (білок волосся). У багатьох білках одночасно зустрічаються ділянки 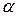 -спіралі і β -структури.
-спіралі і β -структури.
Третинна структура характеризується розташуванням у просторі спіралізованих поліпептидних ланцюгів з утворенням глобулярних або фібрилярних білкових молекул. Утворення третинної структури обумовлено взаємодією функціональних груп радикалів амінокислот.
Четвертинна структура білка — це просторове розміщення кількох білкових поліпептидних ланцюгів, кожний з яких має певні первинну, вторинну і третинну структури.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 3817; Нарушение авторских прав?; Мы поможем в написании вашей работы!