
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные теоретические сведения. Цель работы − изучить термодинамические процессы, познакомиться с термодинамическим методом исследования
|
|
|
|
ИЗМЕРЕНИЕ УДЕЛЬНЫХ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА МЕТОДОМ КЛЕМАНА-ДЕЗОРМА
Лабораторная работа № 12
Цель работы − изучить термодинамические процессы, познакомиться с термодинамическим методом исследования, освоить классический метод измерения теплоемкостей.
Оборудование: баллон с распределительным краном, U-образный жидкостный манометр, насос.
Одним из основных законов физики является закон сохранения энергии. В молекулярной физике он формулируется в виде первого начала термодинамики: количество теплоты (Q), сообщенное системе, расходуется на увеличение ее внутренней энергии DU и на совершение системой механической работы (A) против внешних сил:
 (1)
(1)
Внутренней энергией ( ) тела называется суммарная энергия движения и взаимодействия молекул тела. Для идеального газа полагают, что молекулы между собой не взаимодействуют, следовательно, его внутренняя энергия определяется только кинетической энергией движущихся молекул.
) тела называется суммарная энергия движения и взаимодействия молекул тела. Для идеального газа полагают, что молекулы между собой не взаимодействуют, следовательно, его внутренняя энергия определяется только кинетической энергией движущихся молекул.
Единицей измерения внутренней энергии в СИ является 1 Дж (джоуль).
Количество теплоты (Q) – это физическая величина, характеризующая энергию переданную или отданную телу в результате теплообмена.
Единица измерения количества теплоты в СИ: 1 Дж (джоуль)
Теплообменом называется процесс передачи энергии от одного тела к другому без совершения механической работы. Различают три вида теплообмена:
1. теплопроводность (энергия передаётся от одного тела к другому при непосредственном контакте);
2. конвекция (энергия передаётся от одного тела к другому движущимися потоками жидкости или газа);
3. излучение (энергия передаётся от одного тела к другому в виде электромагнитных волн).
Теплоемкостью (С) называется количество теплоты, поглощаемое или отданное телом при изменении его температуры на 1 градус (1 °С или 1 К):
 (1)
(1)
Единицей измерения теплоемкости в СИ является 1 Дж/К (джоуль на кельвин).
Количество теплоты, поглощаемое или отданное телом единичной массы при изменении его температуры на 1 градус (1 °Сили 1 К) называется удельной теплоемкостью (c) (теплоемкость единицы массы вещества). Удельная теплоемкость определяется соотношением:
 (2)
(2)
Количество теплоты, поглощаемое или отданное одним молем вещества при изменении его температуры на 1 градус (1°С или 1К) называется молярной (мольной) теплоемкостью (Cμ). Молярная теплоемкость связана с удельной соотношением
 , (3)
, (3)
где m - молярная масса вещества.
Количество теплоты, поглощаемое или отданное телом единичного объёма при изменении его температуры на 1 градус (1°С или 1К) называется объёмной теплоемкостью (cоб) (теплоемкость единицы объёма вещества). Объёмная теплоемкость определяется соотношением:
 (4)
(4)
Единицей измерения удельной теплоемкости в СИ является 1 Дж/(кг∙К) (джоуль на килограмм-кельвин), объёмной 1 Дж/(м3∙К) (джоуль на кубический метр-кельвин), молярной 1 Дж/(моль∙К) (джоуль на моль-кельвин).
Количество теплоты, поглощенное или отданное телом при изменении его состояния, зависит не только от начальной и конечной температур, но и от способа перехода из одного состояния в другое.
Обычно выделяют теплоемкость при постоянном давлении (Ср), если в процессе изменения температуры тела поддерживалось постоянным давление и теплоемкость при постоянном объеме (СV) (не путать с объёмной теплоёмкостью!), если в процессе изменения температуры тела поддерживался постоянный объем.
Молярные теплоемкости при постоянном давлении и постоянном объёме определяются следующими соотношениями:
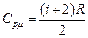 ; (5)
; (5)
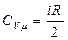 , (6)
, (6)
где  – число степеней свободы (число независимых координат, полностью определяющих положение молекулы в пространстве).
– число степеней свободы (число независимых координат, полностью определяющих положение молекулы в пространстве).
Связь между этими величинами выражается уравнением Майера:
Cpμ = CVμ + R. (7)
Оно показывает, что  всегда больше
всегда больше  на величину молярной (универсальной) газовой постоянной R (прил. 1).
на величину молярной (универсальной) газовой постоянной R (прил. 1).
Значение теплоёмкости при постоянном давлении (Cp) сравнительно просто может быть определено из опыта, а теплоёмкость при постоянном объёме (CV) экспериментальному измерению поддается с трудом. Поэтому чаще всего сначала опытным путем находят отношение Cp/CV, а из него рассчитывают значения теплоемкостей при постоянном давлении и объеме (Cp и CV). Отношение теплоемкостей представляет собой характерную для каждого газа величину и входит в уравнение Пуассонадляадиабатического процесса,поэтому получило название постоянной адиабаты (γ):
g = Cp/CV. (8)
Эту постоянную также часто называют показателем адиабаты или коэффициентом Пуассона.
Адиабатическим процессом (адиабатным) называется процесс, протекающий без теплообмена с окружающей средой (Q = 0).
Уравнение, связывающее термодинамические параметры газа при адиабатическом процессе, называется уравнением адиабаты, или уравнением Пуассона, в честь ученого, который впервые произвел его вывод. Это уравнение можно записать в трех видах:
pVg = const; (9)
TVg-1 = const; (10)
p1-gTg = const. (11)
Из формулы (8) с учетом (5) и (6) следует:
 (12)
(12)
Эта формула показывает, что показатель адиабаты, как и теплоемкости, определяется числом степеней свободы молекул идеального газа.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 335; Нарушение авторских прав?; Мы поможем в написании вашей работы!