
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
От температуры. Закон Кирхгофа
|
|
|
|
Зависимость теплового эффекта реакции
Отношение бесконечно малого количества теплоты, сообщаемой телу, к тому изменению температуры, которое этим вызывается, называется истинной теплоемкостью:
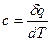
 (12)
(12)
Для изохорных процессов
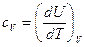 . (13)
. (13)
Для изобарных процессов
 . (14)
. (14)
Эти равенства справедливы для любых веществ и для любого агрегатного состояния.
Для изохорного процесса тепловой эффект определяется величиной изменения внутренней энергии системы D U=U2-U1. Дифференцируя это равенство по температуре, получаем
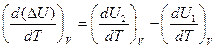 .
.
Так как 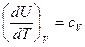 , то
, то
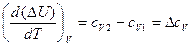 , (15)
, (15)
где сV1 и сV2 – изохорные теплоемкости системы в начальном и конечном состояниях, Δ сV – изменение изохорной теплоемкости при переходе из состояния 1 в состояние 2.
Аналогично для изобарного процесса:
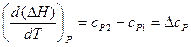 . (16)
. (16)
В общем случае
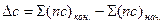 (17)
(17)
Уравнения (15) и (16) выражают закон Кирхгофа:
температурный коэффициент теплового процесса равен изменению теплоемкости системы, происходящему в результате процесса.
Тепловой эффект реакции при любой температуре и давлении, не сильно превышающем одну атмосферу, может быть рассчитан по уравнению Кирхгофа:
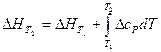 , (18)
, (18)
где Δ сР – разность между суммой изобарных теплоемкостей веществ, стоящих в правой части уравнения реакции, взятых с учетом стехиометрических коэффициентов, и такой же суммой теплоемкостей веществ, стоящих в левой части уравнения; 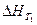 - тепловой эффект реакции при температуре Т 1.
- тепловой эффект реакции при температуре Т 1.
Расчет может быть выполнен, если известны величина теплового эффекта реакции при какой-либо температуре Т 1 (например, стандартной) и температурная зависимость теплоемкостей веществ, участвующих в реакции, в интервале Т 1- Т 2.
Таким образом, чем больше разность между теплоемкостями продуктов реакции и исходных веществ, тем сильнее зависимость теплового эффекта реакции от температуры.
Если теплоемкость с ростом температуры остается неизменной D сP =0 и 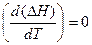 , то изменение температуры не влияет на тепловой эффект реакции.
, то изменение температуры не влияет на тепловой эффект реакции.
Зависимость теплоемкости от температуры обычно выражается эмпирическими приближенными уравнениями вида:
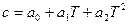
или 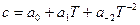 .
.
Если зависимость с (Т) известна в такой форме для всех веществ, участвующих в реакции, то по уравнению (17) определяют Δ с=f (Т). Полученное выражение (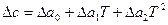 или
или 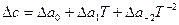 ) подставляют в уравнение Кирхгофа (18) и интегрируют его.
) подставляют в уравнение Кирхгофа (18) и интегрируют его.
Пример. Составим уравнение температурной зависимости теплового эффекта реакции восстановления железа кремнием:
2FeO + Si = SiO2 + 2Fe.
Исходные данные для расчета приведены в таблице.
Таблица
| Реагенты реакции | 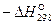 , , 
| 
| ||
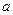
| 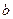
| 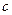
| ||
| FeO | 269,42 | 51,87 | 6,79 | -1,59 |
| Si | - | 24,13 | 2,35 | -4,57 |
| SiO2 | 880,74 | 47,01 | 34,36 | -11,31 |
| Fe | - | 17,51 | 24.80 | - |
Определим температурную зависимость приращения теплоемкости процесса по уравнению:
 .
.
Можно вместо теплоемкостей веществ реакции подставить соответствующие выражения их температурной зависимости и привести выражение к стандартному виду или рассчитать коэффициенты уравнения и подставить их в уравнение
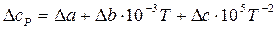 .
.
Рассчитаем коэффициенты:
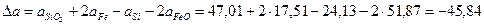
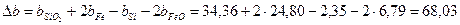
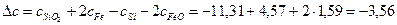
Получаем уравнение температурной зависимости приращения теплоемкости процесса:
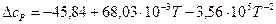 .
.
Подставив полученное выражение в уравнение Кирхгофа и проинтегрировав его в интервале температур от 0К до Т, получим уравнение зависимости теплового эффекта реакции от температуры:
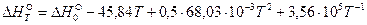 .
.
Для того чтобы найти тепловой эффект  реакции при 0К, подставим
реакции при 0К, подставим 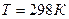 и вместо
и вместо 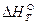 величину
величину  :
:
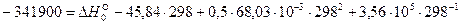
Выполнив вычисления, получаем 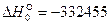 Дж/моль.
Дж/моль.
Уравнение температурной зависимости теплового эффекта реакции имеет вид:  .
.
По данному уравнению можно рассчитать тепловые эффекты реакции для требуемых температур.
НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 466; Нарушение авторских прав?; Мы поможем в написании вашей работы!