
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Линейчатый спектр атома водорода
|
|
|
|
Элементы атомной физики. Модели атома Томсона и Резерфорда.
Лекция №19
Атомы и их спектры. Элементы атомной физики. Модели атома Томсона и Резерфорда. Линейчатый спектр атома водорода. Постулаты Бора. Опыты Франка и Герца. Спектр атома водорода по Бору.
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Томсону. Согласно этой модели, атом представляет собой равномерно заполненный положительным электричеством шар радиусом порядка 10–10 м, внутри которого находится электрон. Суммарный положительный заряд шара равен заряду электрона, так что атом в целом нейтрален. В дальнейшем выяснилась несостоятельность этой модели.
Резерфорд, исследуя прохождение a-частиц через вещество (тонкие фольги толщиной примерно 1 мкм), установил, что основная их часть испытывает незначительные отклонения, но некоторые a-частицы (примерно одна из 20000) значительно отклоняются от первоначального направления (углы отклонения достигали даже 180°). Альфа-частицы возникают при ядерных превращениях и являются ядрами атомов гелия: зарядом 2 e и массой примерно 7300 me. Скорости a-частиц при некоторых превращениях бывают порядка 107 м/с. Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, то столь сильное отклонение a-частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле, которое создается зарядом, имеющим большую массу и сконцентрированном в очень малом объеме. Основываясь на этом выводе, Резерфорд предложил ядерную (планетарную) модель атома. Согласно этой модели в центре атома расположено тяжелое положительное ядро с зарядом Ze, вокруг которого по замкнутым орбитам движутся Z электронов. Ядро имеет размеры, не превышающие 10–14 м, и в котором сконцентрирована практически вся масса атома.
Однако с самого начала ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Электрон в атоме движется с ускорением и согласно классической электродинамике он должен непрерывно излучать электромагнитные волны. Излучение уменьшает энергию электрона, так что он должен достаточно быстро упасть на ядро. Этот результат не соответствует действительности, так как атом является устойчивым образованием. Преодоление возникших трудностей привело к созданию качественно новой – квантовой – теории атома.
Исследования спектров излучения разреженных газов (т.е. спектров излучения отдельных атомов) показали, что каждому газу соответствует определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома – водорода.
Швейцарский ученый И. Бальмер подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра
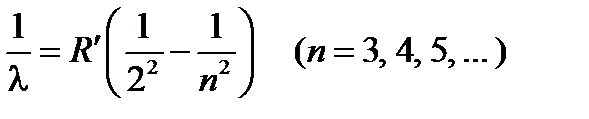 , (19-1)
, (19-1)
где R ¢=1,10×107 м–1 – постоянная Ридберга. Так как 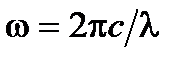 , то формулу (19-1) можно записать в виде
, то формулу (19-1) можно записать в виде
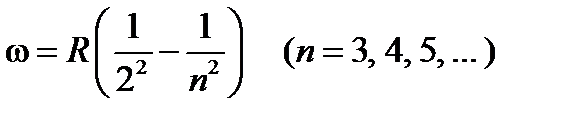 , (19-2)
, (19-2)
где R =2p cR ¢=2,07×1016 рад/с – называется также постоянной Ридберга.
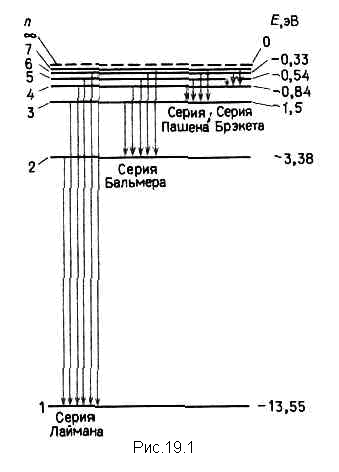
Спектральные линии, отличающиеся значениями n, образуют группу линий, называемой серией Бальмера. С увеличением n линии серии сближаются; значение n =¥ определяют границу серии, к которой со стороны больших частот примыкает сплошной спектр. В дальнейшем в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана
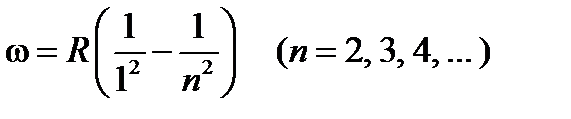 .
.
В инфракрасной области были также обнаружены серия Пашена
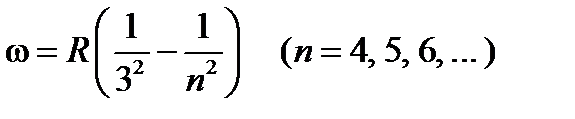 ,
,
серия Брэкета и др. Все приведенные выше серии в спектре водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера
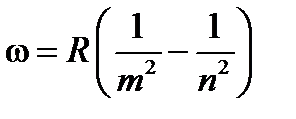 , (19-3)
, (19-3)
где 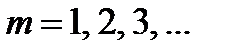 определяет серию,
определяет серию, 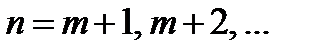 определяет отдельные линии серии.
определяет отдельные линии серии.
Функциональный вид сериальных формул, которые сводятся к одной обобщенной формуле (19-3), свидетельствует о наличии закономерности, объяснить которую в рамках классической физики оказалось невозможным.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1259; Нарушение авторских прав?; Мы поможем в написании вашей работы!