
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия и определения. Термическое (характеристическое) уравнение состояние Клапейронадля1кг
|
|
|
|
Термическое (характеристическое) уравнение состояние Клапейронадля1кг. Идеального газа имеет вид:
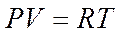 |  | ||
, где: Р - удельное давление (Н/м2);
V - удельный объём (м3/кг);
Т - абсолютная температура(К).
Коэффициент пропорциональности R в уравнении (1) называется газовой характеристической постоянной, величина которой зависит от физической природы газа. При нормальных условиях для воздуха:
молекулярная масса μ=28,96 кг/кмоль
плотность ρ=1,293 кг/м3
объём киломоля Vμ=22,4м3/моль
газовая постоянная R=287 дж/кг*град
Для выяснения физического смысла газовой постоянной запишем уравнение Клапейрона для двух состояний газа при постоянном давлении (изобарный процесс):
PV1=RT1 (2)
PV2=RT2 (3)
 |
Вычитая из уравнения (3) уравнение (2) и преобразуя, получим:
Уравнение (4) показывает, что газовая постоянная по своему физическому смыслу является работой, совершаемой 1кг. газа в изобарном процессе при изменении его температуры на 1 градус.
Величина R в уравнении Клапейрона (1) является постоянной для каждого газа в отдельности.
Уравнению (1) можно придать универсальную форму записи, если газовую постоянную отнести не к 1 кг, а к 1 киломолю (молю) газа. Для этого приводим некоторые определения:
Молекулярная масса газа μ (кг/кмоль) – есть численное выражение отношения массы молекулы данного вещества к 1/12 массы атома изотопа углерода 12С.
Килограмм- молекула (киломоль, моль)- количество газа, масса которого в килограммах численно равна его молекулярной массе (например, для кислорода моль равен 32 кг, для азота- 28 кг и т.д.). Из закона Авогадро следует, что объём киломоля (μV=Vμ) при одинаковых физических условиях имеет постоянное значение.
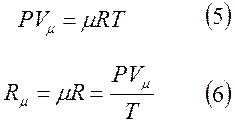 |
Тогда уравнение состояния для 1 моля газа и выражение Rμ запишутся в виде:
Vμ - объём 1 моля м3/моль
μ - масса киломоля данного газа кг/кмоль
Произведение μR в уравнении (6) называется универсальной газовой постоянной и по физическому смыслу является работой 1 киломоля идеального газа в изобарном процессе при изменении его температуры на 1 градус.
Для нормальных физических условий численное значение универсальной газовой постоянной в технической и СИ системах измерения будут одинаковы для всех газов и равны соответственно:
 |
 |
Индивидуальная газовая постоянная в двух системах измерения, отнесенная к 1 кг газа при этом будет равной:
Тогда универсальное уравнение состояния запишется в виде:
PVμ=848 TМКГСС; PVμ=8314 TСИ (7)
Vμ - объём моля;
μ - масса киломоля газа.
Уравнение (7) называют уравнением Клапейрона – Менделеева, т.к. оно впервые было предложено Менделеевым в 1874 г.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 929; Нарушение авторских прав?; Мы поможем в написании вашей работы!