
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В изолированной системе 1 страница
|
|
|
|
А) Р = const, T = const;
B) P = const, V = const;
C) U = const, V = const;
D) U = const, T = const;
E) V = const, T = const.
$$$ 7
При каком процессе, производимом идеальным газом, справедлива формула для работы?
А = Р(V2 - V1)?
А) изотермическом;
В) изобарном;
С) изохорном;
D) адиабатическом;
Е) любом обратимом.
$$$ 8
Как выражается 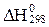 реакции через теплоты образования участвующих в ней веществ (
реакции через теплоты образования участвующих в ней веществ ( ): 4СО + 2SО2 = S2 + 4CO2
): 4СО + 2SО2 = S2 + 4CO2
А)  ;
;
В)  ;
;
С) 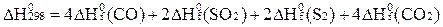 ;
;
D) 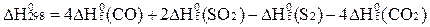 ;
;
Е)  .
.
$$$ 9
Какую размерность имеет молярная теплоемкость?
А) Дж/моль;
В) Дж/К;
С) Дж/моль К;
D) Дж моль/К;
Е) моль К/Дж.
$$$ 20
Стандартная теплота сгорания углерода (С) равна  кДж/моль. В какой из приведенных реакции тепловой эффект при Т = 298К равен этой величине?
кДж/моль. В какой из приведенных реакции тепловой эффект при Т = 298К равен этой величине?
А) С + О2 = СО2;
В) С + 1/2 О2 = СО;
С) СО + 1/2О2 = СО2;
D) 2С + 2Н2 = С2Н4;
Е) С + Н2О = СО + Н2.
$$$ 11
Стандартная теплота образования HCI  кДж/моль.
кДж/моль.
Чему равен стандартный тепловой эффект реакции?
2HCI(г) = H2 + CI2
А) -92,3 кДж/моль;
В) 92,3 кДж/моль;
С) 184,6 кДж/моль;
D) -184,6 кДж/моль;
Е) необходимы дополнительные данные.
$$$ 12
Закрытой системой называется система, которая......
А) обменивается с окружающей средой и веществом, и энергией;
В) не обменивается ни веществом, ни энергией с окружающей средой;
С) обменивается веществом и не обменивается энергией с окружающей средой;
D) имеет U = const;
Е) обменивается энергией и не обменивается веществом с окружающей средой.
$$$13
Для какого процесса справедлива формула:
qp = DH?
А) для изохорного;
В) для любого обратимого;
С) для адиабатического;
D) для изобарного;
Е) для изотермического.
$$$ 14
Как выражается тепловой эффект реакции (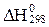 ) через стандартные теплоты образования веществ (
) через стандартные теплоты образования веществ (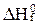 ):
):

 4Ag + О2 2Ag2O
4Ag + О2 2Ag2O
А) 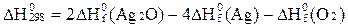 ;
;
В) 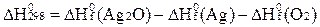 ;
;
С) 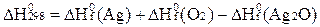 ;
;
D)  ;
;
Е)  .
.
$$$ 15
Тепловой эффект реакции возрастает с увеличением температуры, если
А) DG < 0;
В) DG > 0;
С) DCp > 0;
D) DCp < 0;
Е) DH > 0.
$$$ 16
Стандартная энтальпия образования газообразной воды  равна
равна
-241,84 кДж/моль, а жидкой воды  кДж/моль. Чему
кДж/моль. Чему
равна энтальпия фазового перехода (процесса испарения):
Н2О(ж) ® Н2О(г)?
А) 44,11 кДж/моль;
В) -44,11 кДж/моль;
С) 241,84 кДж/моль;
D) -285,95 кДж/моль;
Е) 527,79 кДж/моль.
$$$ 17
Открытой системой называется система, которая......
А) обменивается с окружающей средой и веществом, и энергией;
В) обменивается только веществом, но не обменивается энергией с окружа-
ющей средой;
С) обменивается только энергией, но не обменивается веществом с окружа-
ющей средой;
D) не обменивается ни веществом, ни энергией с окружающей средой;
Е) имеет Т = const и V = const.
$$$ 18
При экзотермическом процессе:
А) DН = 0;
В) DG = 0;
С) Т = const;
D) DН < 0;
Е) DH > 0.
$$$ 19
При каком процессе вся теплота, данная идеальному газу, превращается в работу его расширения? (q = A)
А) при адиабатическом;
В) при изобарном;
С) при изохорном;
D) при изотермическом;
Е) при любом обратимом.
$$$ 20
Как выражается тепловой эффект реакции 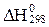 через теплоты образова-ния веществ (
через теплоты образова-ния веществ ( )? 2СО + S2 = 2COS
)? 2СО + S2 = 2COS
А) 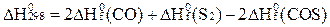 ;
;
B)  ;
;
C) 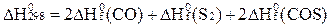 ;
;
D)  ;
;
Е)  .
.
$$$ 21
Изолированной системой называется система, которая....
А) обменивается с окружающей средой и энергией и веществом.
В) не обменивается ни энергией, ни веществом с окружающей средой.
С) обменивается энергией, но не обменивается веществом с окружающей средой.
D) обменивается веществом, но не обменивается энергией с окружающей средой.
Е) имеет T = const и P = const.
$$$ 22
При эндотермическом процессе
А) DН = 0;
В) DG = 0;
С) T = const;
D) D H < 0;
Е) D H > 0.
$$$ 23
Для какого процесса справедлива формула:
А = Сv (T1 - T2)?
А) для изотермического;
В) для изобарного;
С) для изохорного;
D) для любого обратимого;
Е) для адиабатического.
$$$ 24
Как выражается 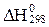 реакции через теплоты образования участвующих в ней веществ (
реакции через теплоты образования участвующих в ней веществ ( )?
)?
4Fe3O4 + O2 = 6Fe2О3
А)  ;
;
В)  ;
;
С) 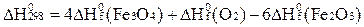 ;
;
D)  ;
;
Е)  .
.
$$$ 25
Стандартная теплота образования диокcида азота 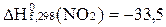 кДж/моль. В какой из приведенных реакций тепловой эффект при Т = 298К равен этой величине?
кДж/моль. В какой из приведенных реакций тепловой эффект при Т = 298К равен этой величине?
А) N2 + 2O2 = 2NO2;
B) 2NO + O2 = 2NO2;
C) 1/2N2 + O2 = NO2;
D) NO + 1/2 O2 = NO2;
E) 4NH3 + 7O2 = 4NO2 + 6H2O.
$$$ 26
Какую размерность имеет энтропия 1 моля вещества?
А) Дж;
В) Дж/К;
С) Дж/моль;
D) Дж/моль К;
Е) Дж/кг.
$$$ 27
Адиабатный процесс, это процесс протекающий при....
А) T = const;
В) P = const;
С) dU = 0;
D) dA = 0;
Е) dq = 0.
$$$ 28
Для какого процесса справедлива формула?
qv = DU?
А) для изотермического;
В) для изохорного;
С) для изобарного;
D) для адиабатического;
Е) для любого обратимого.
$$$ 29
Как выражается 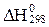 реакции через теплоты образования веществ (
реакции через теплоты образования веществ ( )?
)?
С + 2Н2О = СО2 + 2Н2
А) 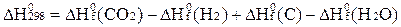 ;
;
В)  ;
;
С)  ;
;
D) 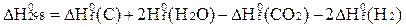 ;
;
Е)  .
.
$$$ 30
Тепловой эффект реакции уменьшается с увеличением температуры, если
А) DСр < 0;
В) D Ср > 0;
С) DН < 0;
D) DG < 0;
Е) D S < 0.
$$$ 31
Укажите какое уравнение связывает I и II законы термодинамики?
А) ТdS = dU + PdV;
В) dS = dq/T;
C) dq = dU + PdV;
D) dG =- SdT + VdP;
Е) dF = - TdS + PdV.
$$$ 32
Как изменяется температура кипения Н2О с ростом внешнего давления?
А) уменьшается;
В) не изменяется;
С) увеличивается;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 33
Каково поведение энтропии изолированной системы при протекании в ней самопроизвольных процессов?
А) всегда убывает;
В) всегда возрастает;
С) не изменяется;
D) может и возрастать и убывать;
Е) сначала возрастает, затем убывает.
$$$ 34
Как ведет себя энергия Гельмгольца вещества при его расширении при
Т = const?
А) возрастает;
В) убывает;
С) не изменяется;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 35
Какую функцию необходимо рассчитать, чтобы узнать, возможно ли данная реакция при Р и Т = const?
А)  ;
;
В) 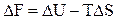 ;
;
С) DG = D H – ТD S;
D) D H = D U + D nRT;
Е) никакую из приведенных.
$$$ 36
Укажите уравнение зависимости теплового эффекта реакции от темпера-
туры:
А) dH = CpdT;
B) dD H/dT = DCp;
C) dq = TdS;
D) dU/dT = Cv;
Е) dq = dA + dU.
$$$ 37
Для каких процессов применимо уравнение Клаузиуса - Клапейрона вида:
 ?
?
А) для любых фазовых превращений;
В) для процесса плавления;
С) для процесса испарения;
D) для любых обратимых;
Е) для любых необратимых.
$$$ 38
Как изменяется энтропия при плавлении твердого тела и при испарении жидкости?
А) увеличивается в обоих случаях;
В) уменьшается в обоих случаях;
С) не изменяется;
D) увеличивается при плавлении и уменьшается при испарении;
Е) уменьшается при плавлении и увеличивается при испарении.
$$$ 39
При постоянных V и Т самопроизвольные процессы протекают, если
А) возрастает энтропия (D S>0);
В) убывает энергия Гиббса (DG <0);
С) возрастает энтальпия (DН >0);
D) возрастает энергия Гельмгольца (D F > 0);
Е) убывает энергия Гельмгольца (DF < 0).
$$$ 40
Как изменяется энтропия при увеличение давления при T = const?
А) возрастает;
В) убывает;
С) не изменяется;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 41
Рассчитать DG, если DH = 20,0 кДж, DS = 100 Дж, а Т = 300К?
А) -10 кДж;
В) 30 кДж;
С) 50 кДж;
D) -0,67 кДж;
Е) -600 кДж.
$$$ 42
Как изменяются температуры кипения и замерзания воды с ростом давления?
А) не изменяются;
В) увеличиваются;
С) уменьшаются;
D) температура кипения увеличивается, а температура замерзания уменьшается;
Е) температура кипения уменьшается, а температура замерзания увеличивается;
$$$ 43
Для каких процессов справедливо соотношение: DS = q/T?
А) для любых;
В) для любых изотермических;
С) для любых обратимых;
D) для обратимых изотермических;
Е) ни для каких из приведенных.
$$$ 44
Какая из приведенных функции служит критерием равновесия в системе при Р и Т = const?
А) энергия Гельмгольца (F);
В) энтропия (S);
С) энтальпия (H);
D) внутренняя энергия (U);
Е) энергия Гиббса (G).
$$$ 45
Как ведет себя энергия Гельмгольца при нагревании при V = const?
А) возрастает;
В) убывает;
С) не изменяется;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 46
Чему равно DSкип одного моля вещества, если его DНисп = 30,0 кДж/моль, Ткип=300К?
А) 10 кДж/К;
В) 0,1 кДж/К;
С) 90000 кДж/К;
D) 270 кДж/К;
Е) 330 кДж/К.
$$$ 47
Как изменяется температура плавления железа и висмута с ростом давления?
А) не изменяется в обоих случаях;
В) увеличивается в обоих случаях;
С) уменьшается в обоих случаях;
D) увеличивается для железа и уменьшается для висмута;
Е) уменьшается для железа и увеличивается для висмута.
$$$ 48
Для какой системы изменение энтропии позволяет установить направление самопроизвольных процессов?
А) открытой;
В) закрытой;
С) любой;
D) изолированной;
Е) ни для какой из выше указанных.
$$$ 49
Состояние равновесия в системе при Р и Т = const характеризуется следующим соотношением:
А) DS = 0;
В) DG < 0;
С) DG > 0;
D) DF = 0;
Е) DG = 0.
$$$ 50
Как ведет себя энергия Гиббса вещества при его нагревании при Р = const?
А) всегда возрастает;
В) всегда убывает;
С) не изменяется;
D) проходит через максимум;
Е) проходит через минимум.
$$$ 51
По какому из графиков можно определить теплоту испарения?
 A)
A)
B)
 |
C)

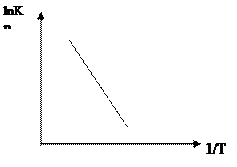 D)
D)
E)

$$$ 52
Какой из перечисленных ниже наборов термодинамических данных нужно найти в справочнике для расчета Кр химической реакции при заданной температуре, используя приближенное уравнение Кирхгоффа?
А) 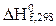 и
и  продуктов реакции;
продуктов реакции;
В) 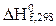 и
и  всех веществ;
всех веществ;
С) 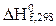 и
и  , Ср продуктов реакций;
, Ср продуктов реакций;
D) 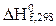 и
и  , Ср всех веществ;
, Ср всех веществ;
Е) 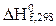 , Ср - всех веществ.
, Ср - всех веществ.
$$$ 53
Найдите константу равновесия следующей реакции:

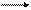 H2 + J2 2HJ
H2 + J2 2HJ
если равновесные концентрации веществ следующие: C(HJ) =0,03 моль/л,
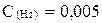 моль/л,
моль/л,  моль/л.
моль/л.
А) 1200;
В) 0,028;
С) 30;
D) 36;
Е) 0,009.
$$$ 54
От каких факторов зависит константа равновесия КС?
А) только от температуры;
В) только от концентрации веществ;
С) только от природы веществ;
D) от температуры и концентрации;
Е) от температуры и природы веществ.
$$$ 55
Укажите правильную формулу связи между Кр и Кс гетерогенной реакции
Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(г)
А) KP = KC(RT);
В) KP = KC(RT)2;
С) КР = КС;
D) KP = KC /(RT);
Е) KP = KC /(RT)2.
$$$ 56
Как изменятся константы равновесия Кх следующих реакции при увеличении давления?

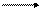 1) 2C(т) + О2 2СО
1) 2C(т) + О2 2СО

 2) 2NO + O2 2NO2
2) 2NO + O2 2NO2
А) Кх(I) - увеличивается; Кх (2) - уменьшается;
В) Кх(I) - увеличивается; Кх (2) - не изменяется;
С) Кх(I) - уменьшается; Кх (2) - увеличивается;
D) Обе константы не изменяется;
E) Обе константы увеличивается.
$$$ 57
Найдите константу равновесия следующей реакции:
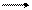
 2SO2 + O2 2SO3
2SO2 + O2 2SO3
если равновесные концентрации веществ следующие: 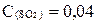 моль/л,
моль/л, 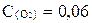 моль/л;
моль/л;  моль/л.
моль/л.
А) 8,33;
В) 4,17;
С) 0,24;
D) 0,12;
Е) 5,0.
$$$ 58
Укажите правильную запись для константы равновесия гетерогенной
реакции

 SiH4(г) Si(т) + 2 H2(г)
SiH4(г) Si(т) + 2 H2(г)
А)  ;
;
В)  ;
;
С)  ;
;
D) 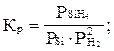
Е) 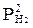 .
.
$$$ 59
Если тепловой эффект реакции равен нулю (DH = 0), то как изменяются Кр и
Кс с ростом температуры?
А) увеличиваются;
В) уменьшаются;
С) не изменяются;
D) Кр уменьшается; Кс увеличивается
Е). Кс уменьшается; Кр увеличивается
$$$ 60
Укажите правильную формулу связи между КР и КС гетерогенной реакций

 4Ag2(т) + O2 2 Ag2O(т)
4Ag2(т) + O2 2 Ag2O(т)
А) КР = КС;
В) KP = KC(RT);
С) KP = KC(RT)-3;
D) KP = KC /RT;
Е) KP = KC(RT)2.
$$$ 61
Как изменится константа равновесия Кх следующих реакции при увеличении давления?

 1) N2O4 2NO2
1) N2O4 2NO2
 2) 6C(т) + 3H2(г) C6H6(г)
2) 6C(т) + 3H2(г) C6H6(г)
А) Кх(1) - уменьшается; Кх(2) - увеличивается;
В) Кх(1) - увеличивается; Кх(2) - уменьшается;
С) Кх(1) и Кх(2) - увеличиваются;
D) Кх(1) и Кх(2) - уменьшаются;
Е) Кх(1) и Кх(2) - не изменяются.
$$$ 62
Найдите константу равновесия следующей реакции:

 СО + CI2 COCI2
СО + CI2 COCI2
если равновесные концентрации веществ равны:
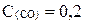 моль/л,
моль/л,  моль/л,
моль/л, 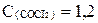 моль/л.
моль/л.
А) 2,4;
В) 0,42;
С) 36;
D) 24;
Е) 20.
$$$ 63
Укажите правильную запись для константы равновесия гетерогенной реакции:
Са(т) + 2СН4(г) = СаС2(т) + 4Н2
А) 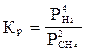 ;
;
В)  ;
;
С) 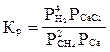 ;
;
D) 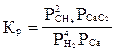 ;
;
Е)  .
.
$$$ 64
От чего зависит константа равновесия Кр химической реакции?
А) от общего давления;
В) от температуры;
С) от парциальных давлений веществ;
D) от температуры и общего давления;
Е) от парциальных давлений веществ и температуры.
$$$ 65
Укажите правильную формулу связи между КР и КС гетерогенной реакции
С(т) + 2H2О = СО2 + 2H2
А) KP = KC /RT2;
В) KP = KC /(RT)2;
С) КР = КС;
D) KP = KC (RT);
Е) KP = KC /RT;
$$$ 66
Как изменится константа равновесия Кх следующих реакции при увеличении давления?
1) СO + CI2 = COCI2
2) 2H2 + O2 = 2H2O
А) Кх(1) - уменьшается; Кх(2) - увеличивается;
В) Кх(1) - увеличивается; Кх(2) - уменьшается;
С) Кх(1) и Кх(2) - увеличиваются;
D) Кх(1) и Кх(2) - уменьшаются;
Е) Кх(1) и Кх(2) - не изменяются.
$$$ 67
Найдите константу равновесия Кс следующей реакции:

 N2 + 3H2 2NH3
N2 + 3H2 2NH3
если равновесные концентрации веществ равны:
 моль/л,
моль/л,  моль/л,
моль/л, 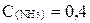 моль/л.
моль/л.
А) 4000;
В) 100;
С) 0,00025;
D) 0,001;
Е) 24,8.
$$$ 68
Укажите правильную запись уравнения изотермы Вант-Гоффа для реакции:
Fe2O3 + CO = 2FeO + CO2
A)  ;
;
B)  ;
;
C)  ;
;
D)  ;
;
E)  .
.
$$$ 69
Как изменяется Кр с ростом температуры, если данная реакция эндотермическая (DН > 0)?
А) возрастает;
В) убывает;
С) не изменяется;
D) сначала возрастает, затем не изменяется;
Е) сначала убывает, затем не изменяется.
$$$ 70
Укажите формулу связи между КР и КС гетерогенной реакции
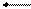
 С(т) + 2Н2 СН4
С(т) + 2Н2 СН4
А) KP = KC;
В) KP = KC(RT)2;
С) KP = KC(RT)-1;
D) KP = KC(RT)3;
Е) КР = КС / (RT)2.
$$$ 71
Как изменится константа равновесия Кх следующих реакций при
увеличении давления?

 1) 2SO2 + O2 2SO3
1) 2SO2 + O2 2SO3

 2) Br2 + H2 2HBr
2) Br2 + H2 2HBr
А) Кх(1) - увеличивается; Кх(2) - уменьшается;
В) Кх(1) - увеличивается; Кх(2) - не изменяется;
С) Кх(1) - уменьшается; Кх(2) - увеличивается;
D) обе константы не изменяются;
Е) обе константы увеличиваются.
$$$ 72
Найдите константу равновесия Кс реакции:

 H2 + J2 2HJ
H2 + J2 2HJ
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 786; Нарушение авторских прав?; Мы поможем в написании вашей работы!