
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Шымкент, 2014 1 страница
|
|
|
|
№1 лекция. Кіріспе. Катализдің негізгі принциптері
Химиялық кинетика мен катализ бөлімінде химиялық реакциялардың жылдамдығы мен олардың молекулалык механизміне арналған жалпы мәселелер, гетерогенді процестер мен олардын жылдамдығына температура, қысым, еріткіш, катализаторлардың әсерлері қарастырылады.
Катализатор – химиялық реакцияның жылдамдығын өзгертіп, бірақ өздері процестің нәтижесінде өзгермей қалатын заттар.
Каталитикалық процесс немесе катализ – катализатордың әсерінен жылдамдығы өзгеретін процестер.
Химиялық кинетика химиялық реакциялардың жылдамдығын, механизмін және оған әр түрлі факторлардан әсерін зерттейтін ғылым. Химиялық реакцияның жылдамдығы кесімді уақыт аралығыңда реакцияға қатысушы заттардың концентрациясының өзгеурімен сипатталады. Реакция жылдамдығын реакция өнімдерінің біреуінің концентрациясының артуымен де анықтауға болады. Реакция жылдамдығығының өлшемі: моль/л.сек немесе моль/л.мин.
Реакция барысында реакцияға қатысушы заттардың концентрациясы кеміп, ал реакция өнімдерінің концентрациясы артады. Химиялық кинетика – химиялық процестердің жылдамдығын, механизмін және оларға әртүрлі факторлардың (концентрация, темпе-ратура, катализатор, орта, т.б.) әсерін зерттейтін ілім. Химиялық реак-циялардың өту заңдылықтары тепе-теңдік емес жағдайда яғни уақыт өтуімен байланысты қарастырылады.
Химиялық процестер гомогенді және гетерогенді болып екіге бөлінеді. Реакцияға түсетін (бастапқы) және реакциядан шығатын (соңғы) заттардың бәрі бір фазада болатын болса, ондай реакциялар гомогенді, ал әр түрлі фазада болса гетерогенді деп аталады. Гомо-генді, ал әр түрлі фазада болса гетерогенді деп аталады. Гомогенді процесте реакция бір фазаның ішінде, ал гетерогенді процесте екі фазаның бөліну беттері шекарасында өтеді.
Гомогенді реакцияның жылдамдығы деп реакцияға ұшырайтын заттың немесе реакциядан шығатын концентрациясының уақыт бірілі-гіндегі (І сек, І мин т.с.) өзгерісін айтады:
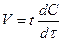 (1)
(1)
Мұндағы:
V – реакция жылдамдығы;
dc/dτ – уақыт берілгендегі концентрацияның өзгерісі.
Реакция теңдеуін жалпы түрде былай жазайық:
а1А1 + а2А2 ·... · аКАК = в1В1 + в2В2... в1В1 (2)
Бұл теңдеудегі әрбір зат бойынша алынған жылдамдықтар өзара байланыста болғандықтан, жалпы реакцияның жылдамдығы:
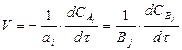 (3)
(3)
Реакция жылдамдығының реакцияға түсетін заттардың концен-трациясы мен байланысы массалар әрекеттеу заңымен анықталады. Егер (2) –реакция болатын болса, онда жылдамдықтың теңдеуі (химиялық кинетиканың негізгі заңы) былай жазылады:
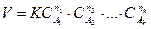 (4)
(4)
Мұндағы:
n1 · n2 … n2 – бүтін сандар, ni мәні ai мәніне тең болуы да
немесе тең болмауы да мүмкін;
К – жылдамдық константасы (жылдамдық тұрақтысы).
Катализатор активтігі, талғамдығы және жарамдылық мерзімі бойынша белгілі талаптарға сай болуы керек. Ең активті және талғамды катализаторды таңдау қиын емес. Бірақ ооның жарамдылық мерзімін анықтау қиын және ұзақ, сондықтан катализаторды дұрыс таңдау өте маңызды. Мына жағдайларды ескеру керек:
1. Температура, қысым, шикізат құрамын анықтап алу керек.
2. Қосалқы реакциялар және реакция өнімінің ыдырау мүмкіндігін ескеру керек.
3. Экономикалық факторлар(шикізат реактордың бағасы,энергия үнемдеу т.б.)ескеру керек.
4. Түзілетін қосалқы өнімдердің бағалығын және оны бөліп алу мүмкіндігін ескеру керек.
5. Реакция жағдайында тұрақты болатын материалдарды анықтау. Мысалы:гидролиз реакциясында кейбір металлдар және сутекпен тотықсызданбайтын оксидтер тұрақты болады.
6. Тұрақты материалдардың қайсы осы реакцияда катализдік активті болатынын анықтайды. Ол үшін бұрынғы тәжірибені пайдаланады немесе химияның басқа бөлімдерінің мәліметтерін пайдаланады.
7. Катализаторды тасымалдағышқа бекіту мүмкіндігін анықтайды. Егер тасмалдағыш қажет болса оны мұқият таңдайды. Оның да берілген жағдайда тұрақтылығын анықтайды. Мысалы: SiO2 тасмалдағышын фторлау реакцияда пайдалануға болмайды, себебі ұшқыш қосылыс SiF4 түзіліп кетеді.
8. Катализатордың үйкеліске қарсы механикалық беріктігін ескереді.
№2 лекция. Катализдің түрлері. Гомогенді катализ.
Формалы түрде химиялық реакциялар нөлінші ретті, бірінші ретті, екінші ретті т.с.с. болып екіге бөлінеді және реакцияның элементар (қарапайым) сатысында өзгеріске ұшырайтын молекула-лардың санына қарап реакциялар бір молекулалы (мономолекулалы), екі молекулалы (биомолекулалы) және үш молекулалы (тримоле-кулалы) болып бөлінеді.
Реакцияның жалпы реті (4) – теңдеудегі концентрациялардың дәреже көрсеткіштерінің қосындысы тең:
n = n1 + n2 + … + nk
Мұндағы:
n1, n2 … nk – реакцияның әрбір зат бойынша алынған жеке
реттері.
Күрделі реакцияларда реакцияның реті бөлшек сандарға, тіпті теріс сандарға да тең болады.
Бірінші ретті қарапайым реакциялар үшін жылдамдық:
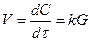 немесе
немесе 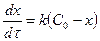 , (5)
, (5)
Мұндағы:
С0 – заттың алғашқы концентрациясы;
Х – заттың берілген dτ уақытта реакция ұшыраған
концентрациясы;
C = (С0 - х) – заттың реакцияға ұшырамаған концентрациясы.
(5) – Теңдеуді интегралдасақ
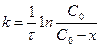 (6)
(6)
Реакцияның жартылай ыдырау периодының теңдеуі:
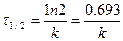 (7)
(7)
Екінші ретті қарапайым үшін
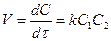 немесе
немесе 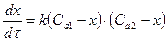 (8)
(8)
Мұндағы:
С0,1 және С0,2 – реакция түсетін екі заттың алғашқы
концентрациялары;
х – олардың реакцияға ұшыраған конценирациясы.
(8) – Теңдеуді интегралдасақ
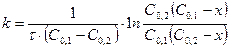 (9)
(9)
Егер С0,1 = С0,2 болса, онда
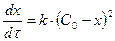 (10)
(10)
Осыдан
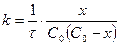 (11)
(11)
Жартылай ыдырау уақытының теңдеуі:
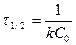 ; (12)
; (12)
Демек, бірінші ретке қарағанда, екінші реті реакцияның жартылай ыдырау периоды заттың бастапқы концентрациясына тәуелді болады.
Үшінші ретті қарапайым реакциялар үшін С0,1=С0,=С0,3жағдай-ында.
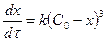 , бұдан
, бұдан
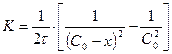 (13)
(13)
Үшінші ретті реакцияның жартылай ыдырау периодының теңдеуі:
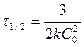 (14)
(14)
Жалпы түрде, яғни n-ші ретті реакция үшін:
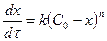 ;
; 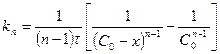 (15)
(15)
Жартылай ыдырау уақытының теңдеуі:
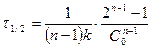 (16)
(16)
Нөлінші ретті реакциялар үшін:
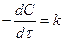 ;
; 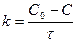 ;
; 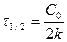 (17)
(17)
Жылдамдық константасының өлшем бірлігін жылдамдықтың теңдеулерінен табуға болады:
Нөлінші ретті реакция үшін 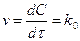 ,
, 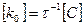 ;
;
Бірінші ретті реакция үшін 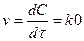 ,
, 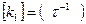 ;
;
Екінші ретті реакция үшін 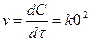 ,
, 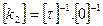 ;
;
Үшінші ретті реакция үшін 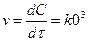 ,
,  ;
;
n-ші ретті реакция үшін 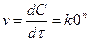 ,
, 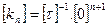
Жылдамдық константаның өлшем бірлігі әр түрлі реакцияларда әр түрлі, сондықтан оларды тек бір түрлі реакциялар үшін ғана бір-бірімен салыстыруға болады. Ал әр түрлі ретті реакцияларды олар-дың жылдамдықтары бойынша салыстырады, себебі жылдамдықтың өлшем бірлігі барлық жағдайларда бірдей.
№3 лекция. Гетерогенді катализ.
Гетерогенді процестер әртүрлі фазалардың шекарасында жүрелі. Оларға еру, кристалдану, булану, конденсациялану процестер және фазалар арасында өтетін химиялық реакциялар, электрод пен ерітінді шекарасында өтетін электрохимиялық реакциялар және гетерогенді катализдік реакциялар жатады. Мысалы, магний оксиді мен тұз қышқылы ерітіндісінің реакциясы қатты фаза мен сұйық фаза шекарасында өтеді:
NgО(қ)+ 2НСl(ер) + Н2О
Гетерогенді прцесс жалпы алғанда мынадай үш сатыдан тұрады:
1) ерітіндіден зат молекуласының қатты дене бетіне келу сатысы (диффузия сатысы);
2) қатты және сұйық фазалардың бөліну бетінде өтетін химиялық реакция сатысы (кинетикалық сатысы);
3) реакциядан шыққан өнімнің қатты дене бетінен бөлініп қайтадан ерітіндіге өту сатысы (кері диффузия).
Бұл сатылардың әрқайсысы тағы да бірнеше сатыларға бөлінуі мүмкін (мысалы, адсорбция және десорбция, қосалқы реакциялар сатысы).
Процестің жалпы жылдамдығы оның ең баяу сатысының жылдамдығымен анықталады (лимиттеуші, шектеуші саты). Егер жылдамдық диффузия сатысымен шектелетін болса, онда бүкіл процесс диффузиялық аймақта өтеді деп есептелінеді де, процестің кинетикасы Фик заңымен сипатталады. Диффузияның Фик заңы бойынша
g = DS 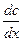 = DS
= DS 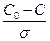 ,
,
Мұндағы:
g – дифузия жылдамдығы;
D – диффузия коэфициенті;
S – диффузия қабатының көлденең қимасының ауданы;
σ – диффузия қабатының қалындығы;
С0 – заттың бастапқы концентрациясы;
С – заттың соңғы (диффузиядан кейін) концентрациясы.
Диффузия жылдамдығына температура онша күшті әсер етпей-ді; диффузия коэфициентінің температураға тәуелділігі
D=D0∙өЕа/RT (84)
Мұндағы:
D0 – тұрақты шама;
Е0 – диффузия процестің активтену энергиясы;
R – универсал газ тұрақтысы;
Т – абсолюттік температура.
Диффузия коэфициентінің тұтқырлықпен байланысы Стокс-Эйнштейн теңдеуімен өрнектеледі:
D = 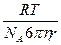 , (85)
, (85)
Мұндағы:
η – тұтқырлық;
r – диффузияланатын бөлшектің радиусы (егер бөлшек шар тәріздес болса).
Қатты заттардың сұйықтарда еру процесінің жылдамдығы (ерітін-ді араластырып отырса) Фик теңдеуімен анқталады: онда оның жылдамдығы
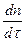 =
= 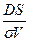 ∙ (СS – С) = k еру (СS – С) (86)
∙ (СS – С) = k еру (СS – С) (86)
Мұндағы:
dn/dτ – заттың уақыт бірлігінде еріген мөлшері;
V – еріткіштің көлемі;
СS – заттың қаныққан ерітіндісінің концентрациясы;
С – заттың ерітіндідегі концентрациясы;
k еру = DS/σV – берілген заттар (еріткіш пен еритын қатты зат) үшін тұрақты шама.
С = const жағдайда еру процесі стационарлы болады.
Бұл кезде (СS–С)/σ= const,
сонда (86) – теңдеудің интегралды түрі мынадай:
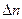 = DS/σV (СS – С) τ, (87)
= DS/σV (СS – С) τ, (87)
Мұндағы:
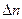 - τ уақыт ішінде еріген зат мөлшеарі.
- τ уақыт ішінде еріген зат мөлшеарі.
Егер еру кезінде С өзгеріп отыратын болса, онда
k еру = 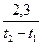 ∙1g
∙1g 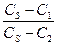 (88)
(88)
Төмендегі типтес гетерогенді мономолекулалы реакциялар үшін (араластыру жылдамдығы тұрақты).
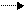 АК + В (газ және сұйық) ерітінді
АК + В (газ және сұйық) ерітінді
Жылдамдықтың эффективті (тиімді) константасы
k∙= βk/(k+β) (89)
Мұндағы:
k – 1-ші ретті химиялық реакцияның өзінің жылдамдық константасы;
β – диффузияның жылдамдық консстантасы, ол тең
β=D/σ, (90)
Мұндағы:
σ – реагенттің диффузиялану қашықтығы.
Диффузиялық аймақта өтетін реакция үшін (k∙=β) кинетикалық теңдеудің дифференциялдық түрі.
- 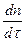 = βS ∙ (С - СS) (91)
= βS ∙ (С - СS) (91)
Мұндағы:
С және СS – В реагенттің ерітіндідегі және қатты А заты бетіндегі концентрациялары.
Егер СS = 0 болса
- 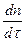 = β∙
= β∙ 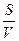 ∙С (92)
∙С (92)
Интегралдасақ
k= 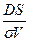 =
= 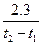 ∙ 1g
∙ 1g 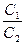 (93)
(93)
Төмендегі типтес реакциялар кинетикалық аймақта өтетін болса және түзілген
А(қ)+В(г)=АВ(қ)
АВ қатты заты А және В заттарының әрекеттесуіне кедергі жасамайтын болса, басқа сөзбен айтқанда, оның кристалдары онша тығыз болмай кеуекті болатын болса реакцияның реті нөлінші, бірінші, екінші және бөлшек санды да болуы мүмкін. Нөлінші реті реакция үшін кинетикалық теңдеудің интегралдық түрі
 = k`τ (94)
= k`τ (94)
Мұндағы:
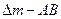 кристалдарының А затының бетінее қонуы нәтижесіндегі А заты массасының өсуі;
кристалдарының А затының бетінее қонуы нәтижесіндегі А заты массасының өсуі;
S – реакция өтетін беттік қабаттың ауданы, ол тұрақты шама;
k – жылдамдық константасы.
Егер А және В заттарының әрекеттесуіне АВ қатты затының өте тығыз қабаты әсер ететін болса, онда реакцияның жылдамдығы диффузия сатысымен шектеледі. Бұл жағдайдағы кинетикалық теңдеуді интегралдық түрі параболаның теңдеуі болып табылады:
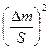 = k``τ,
= k``τ,
Мұндағы:
k`` - жылдамдық константасы, ол А немесе В затының АВ қабатынан диффузияланып өту процесінің константасына (диффузия коэфициентіне, D) пропорционалды.
Қатты заттардың сұйықта еру процесі кинетикалық аймақта өтетін болса ерудің меншікті жылдамдығы
V= 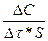 , (95)
, (95)
Мұндағы:
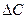 – заттың
– заттың 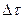 уақытта қатты фазадан ерітінді фазасына көшкен мөлшері, моль/л;
уақытта қатты фазадан ерітінді фазасына көшкен мөлшері, моль/л;
S – заттың беттік қабатының менвшікті ауданы, см2.
Ал еру процестің жылдамдық константасы Шукарев-Доливо-Добровольский теңдеуімен өрнектеледі:
k= 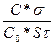 (96)
(96)
Мұндағы:
С – еритін қатты заттың τ уақытта еріген концентрациясы;
σ – стехиометриялық коэфициент, ол заттың 1 мольін
ерітуге қажет еріткіштің моль саны;
С0 – еріткіштің концентрациясы;
n – қатты және сұйық фазалардың бөліну бетіндегі өтетін
химиялық реакцияның реті;
S – беттік қабаттың меншікті ауданы.
№4 лекция. Катализаторлар. Катализаторлардың құрамы.
Белсенді орталығы
Химиялық кинетика мен катализ бөлімінде химиялық реакциялардың жылдамдығы мен олардың молекулалык механизміне арналған жалпы мәселелер, гетерогенді процестер мен олардын жылдамдығына температура, қысым, еріткіш, катализаторлардың әсерлері қарастырылады.
Катализатор – химиялық реакцияның жылдамдығын өзгертіп, бірақ өздері процестің нәтижесінде өзгермей қалатын заттар.
Каталитикалық процесс немесе катализ – катализатордың әсерінен жылдамдығы өзгеретін процестер.
Химиялық кинетика химиялық реакциялардың жылдамдығын, механизмін және оған әр түрлі факторлардан әсерін зерттейтін ғылым. Химиялық реакцияның жылдамдығы кесімді уақыт аралығыңда реакцияға қатысушы заттардың концентрациясының өзгеурімен сипатталады. Реакция жылдамдығын реакция өнімдерінің біреуінің концентрациясының артуымен де анықтауға болады. Реакция жылдамдығығының өлшемі: моль/л.сек немесе моль/л.мин.
Реакция барысында реакцияға қатысушы заттардың концентрациясы кеміп, ал реакция өнімдерінің концентрациясы артады. Бұл өзгерістерді графикпен көрсетуге болады(1 сурет).
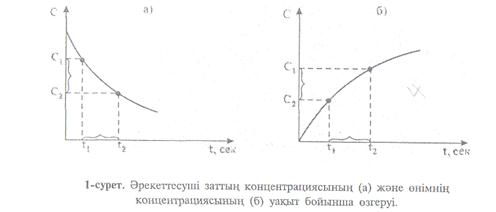
I. А+В=К+Д реакция үшін "А" затының концентрациясы "С1" болғанда уақыт «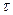 1» болсын, ал уақыт «
1» болсын, ал уақыт «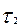 » болғанда "С2" болсын, онда
» болғанда "С2" болсын, онда 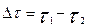 уақыт аралығында концентрация өзгерісі
уақыт аралығында концентрация өзгерісі 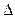 С=С2-С1, бұдан химиялық реакцияның орташа жылдамдығы:
С=С2-С1, бұдан химиялық реакцияның орташа жылдамдығы:

Берілген реакция үшін реакция жылдамдығының әрекеттесуші заттардың концентрациясына байланыстылығын былай жазады:
 [А][В]
[А][В]
К-жылдамдық константасы.
Жылдамдық константасы "К" реакция жылдамдығының әрекеттесуші заттардың табиғатына, температураға және катализатор қатысына тәуелсізділігін көрсетеді.
Егер [А]=[В]=1 моль/л деп алсақ, ондажылдамдықконстантасы тұрақгы температурада реакция жылдамдығына тең (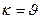 ). Сол себептен химиялық реакциялардың "К" заттардың реакцияға түсу қабілетін сипаттайды.
). Сол себептен химиялық реакциялардың "К" заттардың реакцияға түсу қабілетін сипаттайды.
1.1. Химиялық реакция жылдамдығына катализатордың әсері.
Катализатор-химиялық реакцияның жылдамдығын арттыратын, өзі реакция нәтижесінде өзгеріссіз калатын зат.
Реакция жылдамдығының катализатор қатысында өзгерісін катализ деп атайды. Катализ реакцияға қатысушы заттар мен катализатордың агрегаттық күйіне байланысты гомогенді және гетерогенді болып бөлінеді.
Реакцияны жылдамдататын катализаторларды "оң", ал баяулататын болса, онда "теріс" катализаторлар деп атайды.
Мысалы, аммиак синтезіңде Ғе "оң" катализатор рөлін атқарса, майлардың тотығуын баяулататын лимон қышқылы теріс катализатор болып саналады.
1.2.Химиялық ережесі бойынша температураны әрбір 10°С арттырғанда химиялық реакцияның жылдамдығы шамамен 2-4 есе артады.
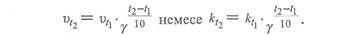
Мұндағы 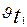 және
және 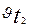 температура t1 және t2болғандағы реакция жылдамдықтары.
температура t1 және t2болғандағы реакция жылдамдықтары.
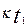 және
және 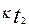 ; t1 және t2 температурадағы жылдамдық константалары;
; t1 және t2 температурадағы жылдамдық константалары; 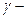 температуралық коэффициент.
температуралық коэффициент.
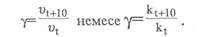
|
Активтендіру теориясы бойынша температураны арттырғанда
системада актив молекулалардың үлесі артады. Ол өз кезінде реакция жылдамдығының артуына әкеп соғады. Демек, температураны арттырғанда актив емес молекулалар қосымша энергия қабылдап, активті күйге келеді.
Әрекеттесуші заттардың молекулаларын активті күйге келтіру үшін қажетті энергиясы активтендіру энергиясы деп атайды. Осы актив молекулалар өзара соқтығысып, реакцияға түседі. Системадағы актив молекулалардың үлесі мына формуламен анықталады:
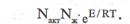
Мұндағы: Е- активтендіру энергаясы, Дж/моль,
R-универсалды газ тұрақгысы, Дж/моль, е-натурал логарифм негізі.
Химиялық реакцияның "К"-мен температура арасындағы тәуелділікті Аррениус теңдеуімен анықгауға болады:
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 2586; Нарушение авторских прав?; Мы поможем в написании вашей работы!