
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические аспекты электрохимических процессов. 1.1 Какие процессы называются электрохимическими?
|
|
|
|
1.1 Какие процессы называются электрохимическими?
Все электрохимические процессы можно разделить на две противоположные группы: процессы электролиза, в которых под действием внешнего источника электроэнергии происходят химические реакции, и процессы возникновения электродвижущей силы и электрического тока вследствие определенных химических реакций.
В первой группе процессов электрическая энергия превращается в химическую, во второй, наоборот, химическая - в электрическую.
Все электрохимические реакции происходят при протекании электрического тока в цепи. Этот круг обязательно состоит из последовательно соединенных металлических проводников и раствора (или расплава) электролита. В металлических проводниках ток переносят электроны, в растворе электролитов - ионы. Непрерывность протекания тока в цепи обеспечивается только тогда, когда происходят процессы на электродах, то есть на границе металл-электролит. На одном электроде происходит процесс приема электронов - восстановление, на втором электроде - процесс отдачи электронов, то есть окисления.
Особенностью электрохимических процессов, в отличие от обычных химических, является пространственное разделение процессов окисления и восстановления. Из этих процессов, которые не могут происходить друг без друга, и состоит в целом химический процесс в электрохимической системе.
1.2 В чем заключается сущность механизма образования электродного потенциала?
Гальванический элемент (химический источник тока) – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из двух электродов (полуэлементов).
Система, в которой металл погружен в раствор собственной соли, называется электродом или полуэлементом. При погружении металлической пластинки в раствор собственной соли имеют место два основных процесса. Первый процесс – это ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы – атомы:
Me ⇄ Men+ + n 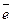
Ионизация происходит под действием полярных молекул растворителя (например, воды). Образующиеся при этом электроны концентрируются на пластинке, заряжая ее отрицательно, а образующиеся катионы металла переходят с пластинки в раствор и концентрируются возле пластинки (рис. 1).
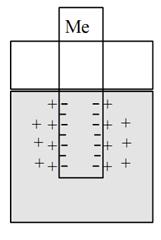
Рис. 1. Схема металлического электрода
Второй процесс – это взаимодействие молекул растворителя с ионами металла, то есть сольватация образующихся ионов:
Men+ + mH2O ⇄ Men+∙mH2O
При погружении пластинки металла в раствор вначале преобладает процесс ионизации металла, но со временем скорость прямой реакции уменьшается, а растет скорость обратной реакции, пока между этими процессами не установится динамическое равновесие:
Me + mH2O ⇄ Men+∙mH2O + n 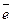
При этом на границе металл-раствор (твердая фаза - жидкость) устанавливается равновесный двойной электрический слой (ДЭС), состоящий из положительных ионов и электронов. Условное обозначение системы металл-раствор – Ме/Меn+, где вертикальной чертой отмечена граница раздела твердая фаза-раствор.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 446; Нарушение авторских прав?; Мы поможем в написании вашей работы!