
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Устройство металлического, газового и окислительно-восстановительного электродов
|
|
|
|
Металлическим электродом называют металлическую пластину, погруженную в раствор или расплав соли этого металла (рис. 1). Подробнее устройство металлического электрода описано в пп. 1.2.
Одним из примеров газового электрода является водородный электрод (рис. 2), устройство которого описано в пп. 1.3.
Данные типы электродов относятся к электродам первого рода, потенциал которых зависит лишь от активности ионов, отдающих или принимающих электроны.
Наряду с электродами первого рода существуют электроды, состоящие из металла, покрытого малорастворимым соединением этого металла (соль, оксид, гидроксид), и погруженные в раствор, содержащий ионы этого малорастворимого соединения. Такие электроды называют электродами второго рода, или окислительно-восстановительными электродами. Типичными представителями являются каломельный, хлорсеребряный, ртутнооксидный и другие электроды.
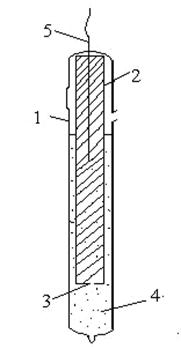
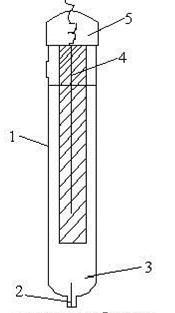
Каломельный электрод представляет собой ртуть, покрытую пастой из каломели (Hg2Cl2) и ртути, находящуюся в растворе хлорида калия (рис. 3):
Hg, Hg2Cl2 | KCl
На каломельном электроде протекает реакция:
Hg2Cl2 + 2 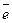 ⇄ 2Hg + 2Cl-
⇄ 2Hg + 2Cl-
Хлорсеребряный электрод представляет собой серебро, покрытое малорастворимым хлоридом серебра, помещенное в раствор, содержащий хлорид-ионы (рис. 4):
Ag, AgCl | Cl-
На электроде протекает реакция:
Ag+ + 1 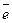 ⇄ Ag
⇄ Ag
Ртутнооксидный электрод представляет собой ртуть, покрытую малорастворимым оксидом ртути, помещенную в раствор щелочи:
Hg, HgO | OH-
На электроде протекает реакция:
Hg + 2OH- - 2 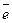 → HgO + H2O
→ HgO + H2O
| 
|
| Рис. 3. Каломельный электрод 1 – стеклянная наружная трубка, 2 – стеклянная внутренняя трубка, которая заполняется пастой из ртути и насыщенного раствора Hg2Cl2 (каломели), 3 – отверстие, 4 – насыщенный раствор КCl, 5 – токоотводящий проводник из платины | Рис. 4. Хлорсеребряный электрод 1 – стеклянный корпус, 2 – асбестовая нить, 3 – насыщенный раствор КCl, 4 – серебряная проволока, покрытая слоем хлорида серебра, 5 – верхняя камера |
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 873; Нарушение авторских прав?; Мы поможем в написании вашей работы!