
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия
|
|
|
|
Закон Авогадро.
В равных объемах различных газов при постоянных температурах и давлении содержится одинаковое число молекул.
Из Закона Авогадро выводится 2 следствия:
1. Один моль любого газа при одинаковых условиях занимает одинаковый объем.
2. Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов.
Эта постоянная величина называется относительной плотностью газов.
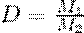 Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
Относительная плотность газов
М - Молярные массы
Произвольная термодинамическая система, находящаяся в любом термодинамическом состоянии обладает полной энергией, складывающейся из кинетической энергии механического движения системы, потенциальной энергии системы во внешних силовых полях и внутренней энергии.
W = Wкмех+Wпвнешн+U
Внутренней энергией тела или термодинамической системы называется энергия, зависящая только от термодинамического состояния тела (системы). Полная энергия всех молекул газа.
Для неподвижной системы, не находящейся во внешних силовых полях, внутренняя энергия совпадает с полной энергией.
Внутренняя энергия является однозначной функцией термодинамического состояния системы.
Значение внутренней энергии в любом состоянии не зависит от того, с помощью какого процесса система пришла в данное состояние. Если система совершает круговой процесс, то полное изменение ее внутренней энергии равно нулю.
В системе, находящейся в состоянии термодинамического равновесия, внутренняя энергия зависит только от температуры и внешних параметров.
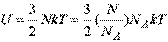 Внутренняя энергия идеального газа зависит только от его термодинамической температуры и пропорциональна массе газа.
Внутренняя энергия идеального газа зависит только от его термодинамической температуры и пропорциональна массе газа.
Внутренняя энергия идеального газа
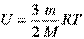 Иначе формулу можно представить в виде:
Иначе формулу можно представить в виде:
Эта формула справедлива для идеального одноатомного газа.
R - универсальная газовая постоянная.
T - температура
N - число молекул
k = 1,38 * 10-23 постоянная Больцмана
m - масса газа
M - молярная масса
Внутренняя энергия газа Ван-дер-Ваальса.
Энергия одного моля газа Ван-дер-Ваальса слагается из внутренней энергии молекул, составляющих газ: кинетической энергии теплового движения центра масс молекул и потенциальной энергии взаимного притяжения молекул.
 Полная энергия одного моля газа Ван-дер-Ваальса определяется соотношением:
Полная энергия одного моля газа Ван-дер-Ваальса определяется соотношением:
Полная энергия одного моля газа Ван-дер-Ваальса
Vm - молярный объём
Cv - молярная теплоёмкость
Внутренняя энергия газа с многоатомными молекулами (аммиак, углекислый газ) состоит из:
- кинетической энергии теплового поступательного и вращательного движения молекул
- кинетической и потенциальной энергии колебаний атомов в молекулах
- потенциальной энергии, обусловленной межмолекулярными взаимодействиями
- энергии электронных оболочек атомов и ионов
- внутриядерной энергии
Количество энергии, переданной системе внешними телами при силовом воздействии между ними, называется работой, совершенной над системой.
Количество энергии, переданной системе внешними телами путем теплообмена, называется количеством теплоты.
Если термодинамическая система неподвижна, то для совершения работы необходимо перемещение взаимодействующих с ней внешних тел, т.е. необходимо изменение внешних параметров состояния системы.
Работой расширения называется работа, которую система производит против внешнего давления. пример - работа газа, заключенного в сосуде с невесомым подвижным поршнем; при сжатии положительную работу над газом совершают силы внешнего давления, а сам газ совершает при этом отрицательную.
δA = pвнешнdV Элементарная работа расширения
pвнешн - равномерно распределенное внешнее давление
dV - элементарное изменение объема системы
Теплообмен происходит между телами, нагретыми до различной температуры. Существуют три вида теплообмена:
- конвективный теплообмен
- теплопроводность
- теплообмен излучением («лучистый» теплообмен)
Конвективным теплообменом называется передача теплоты между движущимися неравномерно нагретыми частями газов, жидкостей или газами, жидкостями и твердыми телами. пример - в батареях водяного отопления энергия от горячей воды, протекающей в батарее, передается конвективным теплообменом к менее нагретым стенкам батареи.
Явление теплопроводности состоит в передаче теплоты от одной части неравномерно нагретого тела к другой. пример - передача энергии через стенки батареи водяного отопления от более нагретых внутренних поверхностей к менее нагретым наружным.
Теплообмен излучением происходит без непосредственного контакта тел, обменивающихся энергией, и заключается в испускании и поглощении телами энергии электромагнитного поля. пример - энергия Солнца.
Работа и теплота являются энергетическими характеристиками процессов изменения состояния термодинамических систем и имеют смысл только в связи с такими процессами.
Открытой системой называется термодинамическая система, которая может обмениваться веществом с внешней средой.
Закрытая система не может обмениваться веществом с внешней средой.
Изолированной называется термодинамическая система, которая не может обмениваться с внешней средой ни энергией, ни веществом.
Замкнутой системой называется термодинамическая система, изолированная в механическом отношении, т.е. не способная к обмену энергией с внешней средой путем совершения работы.
Теплоемкость идеального газа - отношение количества теплоты, сообщённого газу, к изменению температуры δТ, которое при этом произошло.
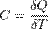
Теплоемкость идеального газа
Теплоёмкость идеального газа в изопроцессах.
Теплоёмкость идеального газа в адиабатическом процессе:
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть DQ = 0
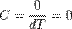
Теплоёмкость идеального газа в изотермическом процессе:
В изотермическом процессе постоянна температура, то есть DT = 0
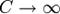
Теплоёмкость идеального газа в изохорном процессе:
В изохорном процессе постоянен объём, то есть δV = 0
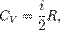
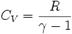
γ - показатель адиабаты
R - универсальная газовая постоянная
Удельной теплоемкостью вещества с -величина, равная количеству теплоты, необходимому для нагревания 1кг вещества на 1К
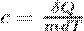
 Молярной теплоемкостью Сm -величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1К.
Молярной теплоемкостью Сm -величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1К.
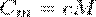 Удельная теплоемкость с связана с молярной теплоемкостью соотношением
Удельная теплоемкость с связана с молярной теплоемкостью соотношением
ν = m/М - количество вещества
М - молярная масса вещества
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 525; Нарушение авторских прав?; Мы поможем в написании вашей работы!