
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сущность гидролиза солей
|
|
|
|
| Соли, реагирующие с водой | Сокращенные ионные, полные ионные и молекулярные уравнения реакций | Среда раствора |
| Хлорид натрия | H2O  H+ + OH–,
Na+ + Cl– + H2O H+ + OH–,
Na+ + Cl– + H2O  Na+ + Cl– + H+ + OH–,
NaCl + H2O Na+ + Cl– + H+ + OH–,
NaCl + H2O 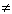 (нет реакции) (нет реакции)
| Нейтральная |
| Kарбонат натрия | 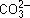 + НОН + НОН  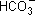 + OН–,
2Na+ + + OН–,
2Na+ + 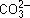 + H2O + H2O  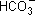 + OН–,
Na2CО3 + H2O + OН–,
Na2CО3 + H2O  NaHCО3 + NaOН NaHCО3 + NaOН
| Щелочная |
| Хлорид алюминия | Al3+ + НОН  AlOH2+ + Н+,
Al3+ + 3Cl– + H2O AlOH2+ + Н+,
Al3+ + 3Cl– + H2O  AlОH2+ + 2Cl– + H+ + Cl–,
AlCl3 + H2O AlОH2+ + 2Cl– + H+ + Cl–,
AlCl3 + H2O  AlOHCl2 + HCl AlOHCl2 + HCl
| Kислая |
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н+ или ОН-, и раствор соли становится кислотным или щелочным соответственно.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония NH4Cl.

В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
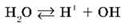
2) полная диссоциация соли (сильного электролита):
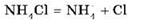
Образующиеся при этом ионы OH- и NH4+ взаимодействуют между собой с получением NH3 · H2O(слабый электролит), тогда как ионы Н+ остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
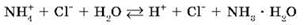
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т. к. вода Н2О — значительно более слабый электролит, чем гидрат аммиака NH3 · H2O.
Сокращенное ионное уравнение гидролиза:

Уравнение показывает, что:
1) в растворе есть свободные ионы водорода Н+, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду (рН < 7);
2) в реакции с водой участвуют катионы аммония NH4+; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные М2+ (например, Ni2+,Cu2+, Zn2+...), кроме катионов щелочноземельных металлов, трехзарядные М3+(например, Fe3+,Al3+, Cr3+...).
Рассмотрим гидролиз нитрата никеля Ni(NO3)2.

Происходит гидролиз соли по катиону Ni2+.
Полное ионное уравнение гидролиза:
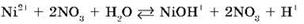
Сокращенное ионное уравнение:

Продукты гидролиза — основная соль NiOHNO3 и азотная кислота HNO3.
Среда водного раствора нитрата никеля кислотная (рН < 7), потому что в растворе увеличивается концентрация ионов Н+.
Гидролиз соли NiOHNO3 протекает в значительно меньшей степени, и им можно пренебречь. Таким образом:
1) по катиону соли, как правило, гидролизуются обратимо;
2) химическое равновесие реакций сильно смещено влево;
3) реакция среды в растворах таких солей кислотная (рН < 7);
4) при гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
3. Соли, образованные слабым основанием и слабой кислотой.
Такие соли подвергаются гидролизу и по катиону, и по аниону.
ЗАПОМНИ. Возможность и характер протекания гидролиза определяется природой основания и кислоты, из которых образована соль.
Катион слабого основания связывает ионы ОН- из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы Н+ из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов — кислоты и основания, которые образуются в результате гидролиза.
Например, рассмотрим гидролиз двух солей: ацетата аммония NH4CH3COO и формиата аммонияNH4HCCO:
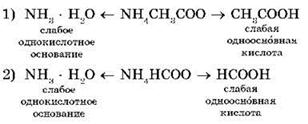
В водных растворах этих солей катионы слабого основания NH4+ взаимодействуют с гидроксид-ионами ОН- (напомним, что вода диссоциирует), а анионы слабых кислотCH3COO- и HCOO- взаимодействуют с катионами Н+ с образованием молекул слабых кислот — уксусной CH3COOH и муравьиной HCOOH.
Запишем ионные уравнения гидролиза:
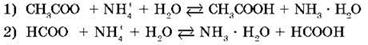
В этих случаях гидролиз тоже обратимый, но равновесие смещено в сторону образования продуктов гидролиза — двух слабых электролитов.
В первом случае среда раствора нейтральная (рН = 7), т. к. КД(СН3СООН) = KД(NH3 · H2O) = 1,8 · 10-5. Во втором случае среда раствора будет слабокислотной (pH < 7), т. к. КД(НСООН) = 2,1 · 10-4и KД(NH3 · Н2О) < КД(НСООН), где КД — константа диссоциации.
Гидролиз большинства солей является обратимым процессом. В состоянии химического равновесия гидролизована лишь часть соли. Однако некоторые соли полностью разлагаются водой, т. е. их гидролиз является необратимым процессом.
Сульфид алюминия Al2S3 в воде подвергается необратимому гидролизу, т. к. появляющиеся при гидролизе по катиону ионы Н+ связываются образующимися при гидролизе по аниону ионами ОН-. Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
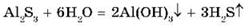
Поэтому сульфид алюминия Al2S3 нельзя получить реакцией обмена между водными растворами двух солей, например, хлорида алюминия AlCl3 и сульфида натрия Na2S.
В результате гидролиза и по катиону, и по аниону:
1) если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо; реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующихся основания и кислоты;
2) соли могут гидролизоваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2693; Нарушение авторских прав?; Мы поможем в написании вашей работы!