
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Присутствие одноименных ионов
|
|
|
|
Температура
Концентрация соли
Природа соли
Факторы, влияющие на степень гидролиза
Степень гидролиза
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр);
α = (c гидр/ c общ)·100 %
где c гидр — число молей гидролизованной соли, c общ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Чем слабее основание и кислота, образующие соль, тем она сильнее гидролизуется.
При разбавлении степень гидролиза растет, так как растет число молекул воды, являющихся исходным веществом в реакции гидролиза, поэтому, по принципу Ле Шателье, равновесие смещается вправо
Гидролиз является эндотермическим процессом, поэтому при повышении температуры степень гидролиза увеличивается, так как равновесие смещается вправо.
Если в раствор соли, имеющий кислую реакцию, добавить кислоту (т.е. ионы 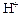 ), то равновесие сместится влево и гидролиз ослабится.
), то равновесие сместится влево и гидролиз ослабится.
Если добавить щелочь (т.е. ионы  ), катионы
), катионы 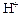 будут связываться в молекулы H2O, и равновесие сместится вправо. Гидролиз усилится.
будут связываться в молекулы H2O, и равновесие сместится вправо. Гидролиз усилится.
Аналогично, если в раствор соли, имеющий щелочную реакцию, добавить щелочь, гидролиз ослабится, а при добавлении кислоты – усилится.
Часто необходимо подавить гидролиз. Для этого растворы солей следует хранить в концентрированном виде при низких температурах.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 532; Нарушение авторских прав?; Мы поможем в написании вашей работы!