
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сущность коррозийных поцессов
|
|
|
|
Где
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Ряд напряжений
Потенциал, возникающий в электрохимической цепи, когда один из электродов опускают в одномолярный раствор соли металла, а вторым электродом является стандартный электрод.
(реже — ряд активностей)
последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов (См. Электродный потенциал) в растворах электролитов. Наибольшие отрицательные потенциалы характерны для щелочных металлов (около — 3 в), за ними следуют щёлочноземельные металлы и т. д.; наиболее положительные потенциалы имеют благородные металлы
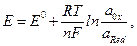
E — электродный потенциал, E 0 — стандартный электродный потенциал, измеряется в вольтах;
R — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T — абсолютная температура;
F — постоянная Фарадея, равная 96485,35 Кл·моль−1;
n — число молей электронов, участвующих в процессе;
a Ox и a Red — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
30.Практическое применение электрохимических процессов в науке, технике, современном производстве. В основе науки о коррозии и технологий борьбы с коррозионными потерями
электрохимические методы защиты от коррозии различных видов аппаратуры
химические источники тока, разработки различных систем гальванических элементов, батареек, аккумуляторов, топливных элементов, электрохимических генераторов, а также технологии их изготовления. Отчистка металов.
-научно обоснованные электрохимические технологии широко применяются для решения экологических проблем, в частности, очистки сточных вод самых различных производств (химических, гальванических, лакокрасочных, нефтяных, биотехнологических), регенерации электролитов, извлечения металлов из промывных вод и отходов производства;
-электрохимический метод лежит в основе технологии обессоливания воды, значительная часть физико-химических методов исследований и анализов зиждется на электрохимических принципах;
-электрохимический синтез простых и сложных неорганических соединений хорошо известен и широко применяется в химической промышленности.
Каждый метал стремится вернуться в привычное состояние. Коррозия металлов - процесс разрушения металлов вследствие химического, электрохимического или биохимического взаимодействии с окружающей средой.
Классификация.
Химическая коррозия– это разрушение металлов в окислительных средах при высоких температурах. Различают два вида: газовая (т. е. окисление металла при нагреве) и коррозия в неэлектролита.
Электрохимическая
атмосферная– характеризует процесс в условиях влажной воздушной среды.
подземная– разрушение металла в почвах и грунтах.
жидкостная коррозия, или коррозия в электролитах. Ее частным случаем является подводная коррозия– разрушение металлических конструкций, погруженных в воду.
Биохимическая коррозия - это процесс, связанный с воздействием микроорганизмов на металл. При этом металл может разрушаться как из-за того, что он служит питательной средой для микроорганизмов, так и под действием продуктов, образующихся в результате их жизнедеятельности. Биохимическая коррозия в чистом виде встречается редко, поскольку в присутствии влаги протекает одновременно и электрохимическая коррозия. Поэтому при рассмотрении отдельных видов коррозии разрушения, вызванные биохимической коррозией, относят к разрушениям от электрохимической коррозии.
32 Электрохимическая коррозия - это самопроизвольное разрушение металлов при их соприкосновении с растворами электролитов, при этом в системе возникает электрический ток. Она протекает:
1) Непосредственно в жидких электролитах
2) В атмосфере любого влажного газа
3) В почве
Основные процессы, протекающие при электрохимической коррозии:
1) анодное окисление металла
Me0 – ne – Men+ (Fe0 – 2e- – Fe2+)
2) катодное восстановление окислителя
pH = 7 (нейтральная среда) O2 + 2H2O + 4e- – 4OH-
pH < 7 (кислая среда) 2H+ + 2e- – H02↑
3) вторичные химические процессы
33 Атмосферной коррозией называют разрушение металлов и сплавов в атмосфере и в средах влажных газов в результате электрохимических и химических процессов.
В зависимости от влажности атмосферы различают несколько видов атмосферной коррозии; мокрую, влажную и сухую коррозию.
Мокрая атмосферная коррозия наблюдается при капельной конденсации влаги на поверхности металла при относительной влажности воздуха, равной 100%. К этому виду коррозии относят разрушения металлических конструкций под воздействием дождя, снега, тумана и др.
Влажная атмосферная коррозия возникает при влажности в атмосфере ниже 100% и сопровождается адсорбционной, капиллярной и химической конденсацией на поверхности металла.
Сухая атмосферная коррозия проходит при относительной влажности ниже 60%, т. е. под действием кислорода воздуха. При этом процессе наблюдается лишь потускнение поверхности металла вследствие образования пленки из продуктов коррозии.
На скорость атмосферной коррозии оказывают влияние свойства образующихся продуктов коррозии, в частности, их гигроскопичность. Так, гигроскопичные продукты коррозии меди и никеля в атмосфере, загрязненной сернистыми газами, способствуют интенсивному поглощению влаги поверхностью металла и дальнейшему усилению коррозии. Негигроскопичные продукты коррозии алюминия хорошо предохраняют металл от дальнейшего разрушения даже при наличии в атмосфере оксида серы (IV).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 500; Нарушение авторских прав?; Мы поможем в написании вашей работы!