
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства воды
вода – весьма активное в химическом отношении вещество.
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH(бурно)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O = H2 + CO(при сильном нагревании)
2) Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:

3) Вода реагирует со многими оксидаминеметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
| SO2 | + | H2O | = | H2SO3 |
| сернистая кислота |
| SO3 | + | H2O | = | H2SO4 |
| серная кислота |
| CO2 | + | H2O | = | H2CO3 |
| угольная кислота |
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
| CaO | + | H2O | = | Ca(OH)2 |
| гидроксид кальция (гашеная известь) |
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Мы уже встречались с такими оксидами. Это ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
http://school-collection.edu.ru/catalog/res/920a7d84-4901-c6ab-ccad-c4cb0bf329c3/view/5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
| CuSO4 | + | 5 H2O | = | CuSO4.5H2O |
| вещество белого цвета (безводный сульфат меди) | кристаллогидрат (медный купорос), синие кристаллы |
Приведем другие примеры образования гидратов:
H2SO4 + H2O = H2SO4 . H2O (гидрат серной кислоты)
NaOH + H2O = NaOH . H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
6) Особая реакция воды – синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
Окисляемость:
Окисляемость - это величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых (при определенных условиях) одним из сильных химических окислителей.
Существует несколько видов окисляемости воды:
- перманганатная;
- бихроматная;
- иодатная;
- цериевая.
Жёсткость воды:
Жесткость воды - определенное свойство воды, которое связывают с растворенными в ней соединениями магния и кальция, то есть наличием в воде катионов этих элементов (при повышении температуры соли этих металлов выпадают в осадок и образуют весьма прочные отложения). Жесткость воды во многом определяет пригодность воды для использования как промышленных, так и в бытовых целях.
Выделяют 2 типа жесткости воды:
- временная – карбонатная жесткость, обусловлена присутствием на ряду с кальцием, магнием и железом гидрокарбонатных анионов;
- постоянная – некарбонатная жесткость, характеризуется присутствием сульфатных, нитратных и хлоридных анионов, соли кальция и магния которых прекрасно растворяются в воде;
- общая жесткость определяется как суммарная величина наличия солей магния и кальция в воде, то есть суммой карбонатной и некарбонатной жесткости.
Принято классифицировать жесткость воды следующим образом:
- мягкая вода – жесткость 3,0 мг-экв/л и более
- средняя жесткость – от 3,0 до 6,0 мг-экв/л
- жесткая вода – свыше 6,0 мг-экв/мл.
Умягчение воды
Умягчение воды в промышленной водоподготовке - очистка от соединений кальция и магния, обусловливающих жесткость воды. Одним из наиболее эффективных способов умягчения воды является известково-содовый в сочетании с фосфатным. Процесс умягчения основывается на следующих реакциях:
1. Обработка гашеной известью для устранения временной жесткости, удаления ионов железа и связывания СО2:
2. Обработка кальцинированной содой для устранения постоянной жесткости:
3. Обработка тринатрийфосфатом для более полного осаждения катионов Са2+ и Mg2+.
Также для умягчения воды применяют мембранные технологии (нанофильтрации и низконапорный обратный осмос), а также технологии ионного обмена.
Катионированиие и анионирование.
Ионитные методы обработки воды основаны на способности некоторых практически нерастворимых в воде материалов вступать в ионный обмен с растворенными в воде солями, сорбируя из обрабатываемой воды одни ионы и отдавая в раствор эквивалентное количество других ионов, которыми ионит периодически насыщается при регенерации. В качестве таких нерастворимых фильтрующих материалов используются катиониты и аниониты.
Катиониты при регенерации их растворами NaCl, H2SO4 или NH4Cl способны обменивать содержащиеся в них катионы (соответственно Na+, H+ или NH4+) на катионы обрабатываемой воды; этот процесс называется катионированием.
Аниониты при их регенерации щелочью NaOH, содой Na2CO3 или поваренной солью NaCl способны как бы заряжаться соответственно анионами ОН-, CO32- или Сl- и затем обменивать их на анионы, содержащиеся в обрабатываемой воде; этот процесс называется анионированием.
Расчёт жёсткости воды:
Количественно жёсткость воды представляет собой молярную концентрацию эквивалента в-ва, обуславливающего жёсткость или требующегося для её устранения, обозначаемую в этом случае как «Ж» и выражаемую в моль-экв/л (моль-экв/дм3, ммоль/л)


52) Физические и химические св-ва кремния. Основные св-ва важнейших соединений кремния.
Физические св-ва:
Кремний (Si) – стоит в 3 периоде, IV группе главной подгруппы периодической системы. Физические свойства: кремний существует в двух модификациях: аморфной и кристаллической. Аморфный кремний – порошок бурого цвета, плотностью 2,33 г/см3, растворяется в расплавах металлов. Кристаллический кремний – это кристаллы темно-серого цвета, обладающие стальным блеском, твердый и хрупкий, плотностью 2,4 г/см3. Кремний состоит из трех изотопов: Si (28), Si (29), Si (30).
Химические св-ва:
Кремний – неметалл. На внешнем энергетическом уровне кремний имеет 4 электрона, что обуславливает его степени окисления: +4, -4, -2. Валентность – 2, 4. Аморфный кремний обладает большей реакционной способностью, чем кристаллический. При обычных условиях он взаимодействует со фтором: Si + 2F2 = SiF4. При 1000 °C Si реагирует с неметаллами: с CL2, N2, C, S.
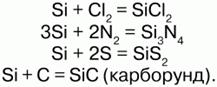
Из кислот кремний взаимодействует только со смесью азотной и плавиковой кислот:

По отношению к металлам ведет себя по-разному: в расплавленных Zn, Al, Sn, Pb он хорошо растворяется, но не реагирует с ними; с другими расплавами металлов – с Mg, Cu, Fe кремний взаимодействует с образованием силицидов: Si + 2Mg = Mg2Si. Кремний горит в кислороде: Si + O2 = SiO2 (песок).
Диоксид кремния или кремнезем – стойкое соединение Si, широко распространен в природе. Реагирует со сплавлением его с щелочами, основными оксидами, образуя соли кремниевой кислоты – силикаты. Получение: в промышленности кремний в чистом виде получают восстановлением диоксида кремния коксом в электропечах: SiO2 + 2С = Si + 2СO?.
В лаборатории кремний получают прокаливанием с магнием или алюминием белого песка:
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2О3 + 3Si.
Кремний образует кислоты: Н2 SiO3 – мета-кремниевая кислота; Н2 Si2O5 – двуметакремниевая кислота.
|
|
Дата добавления: 2014-12-16; Просмотров: 875; Нарушение авторских прав?; Мы поможем в написании вашей работы!