
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок заполнения электронами электронных оболочек. Принцип минимума энергии. Принцип Паули. Правило Хунда
|
|
|
|
Эволюция представлений о строении атома. Модель строения атома Бора. Современное квантово- механическое описание атома. Принцип неопределенности Гейзенберга. Понятие о волновой функции.
Эволюция представлений о строении атома. Модель строения атома Бора. Современное квантово- механическое описание атома. Принцип неопределенности Гейзенберга. Понятие о волновой функции.
Особенности коррозионных процессов стальной арматуры.
Отсутствие коррозии стали в железобетоне объясняется её пассивностью в щелочной среде. Если же поверхность арматуры остаётся активной (или пассивируется частично) при изготовлении конструкции (либо в процессе её эксплуатации), то будет иметь место коррозия арматуры. Для сохранения пассивного состояния арматурной стали в железобетоне необходим её постоянный контакт с поровой жидкостью, имеющий высокую щелочность.
Признаки коррозии: Наличие на поверхности ж/б конструкции пятен ржавчины, образование трещин вдоль арматурных стержней. Причиной коррозии является карбонизация защитного слоя или проникание в бетон солей хлоридов.
Опасна снижением рабочего сечения арматурных стержней, потерей сцепления арматуры с бетоном, сильным снижением несущей способности ж/б конструкций.
1)Эволюция представлений о строении атома. Открытие сложного строения атома – важнейший этап становления современной физики. В процессе создания количественной теории строения атома, позволившей объяснить атомные системы, были сформированы новые представления о свойствах микрочастиц, которые описываются квантовой механикой. Представление об атомах как неделимых мельчайших частицах веществ, как уже отмечалось выше, возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К началу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье (1743–1794), великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона (1766–1844) была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д.И. Менделеев, разработавший в 1869 г. периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. было экспериментально доказано, что электрон является одной из основных частей любого вещества. Первые косвенные подтверждения о сложной структуре атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Изучение свойств этих лучей привело к заключению, что они представляют собой поток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, близкой к скорости света. Особыми приемами удалось определить массу катодных частиц и величину их заряда, выяснить, что они не зависят ни от природы газа, остающегося в трубке, ни от вещества, из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов и превращены в электронейтральные частицы: электрический заряд составляет сущность их природы. Эти частицы, получившие название электронов, были открыты в 1897 г. английским физиком Дж. Томсоном. Изучение строения атома практически началось в 1897–1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Томсон предложил первую модель атома, представив атом как сгусток материи, обладающий положительным электрическим зарядом, в который вкраплено столько электронов, что превращает его в электрически нейтральное образование. В этой модели предполагалось, что под влиянием внешних воздействий электроны могли совершать колебания, т. е. двигаться ускоренно. Казалось бы, это позволяло ответить на вопросы об излучении света атомами вещества и гамма-лучей атомами радиоактивных веществ.В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Поскольку масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой. Предложенная Резерфордом схема строения атома или, как обыкновенно говорят, планетарная модель атома, легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов, поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.
2). Модель строения атома Бора. Планетарная модель атома, созданная Резерфордом, встретила полное недоумение, так как она противоречила казавшимся тогда незыблемыми основам физики. Нужно было как-то объяснить, почему вращающиеся вокруг ядра электроны не излучают энергию и не падают на атомные ядра. Большое значение в развитии представлений о строении атома сыграла модель Н. Бора, которая представляла собой введение квантовых условий в модель Резерфорда, построенную на основе классических представлений. В 1913 г. Н. Бор сформулировал свои знаменитые постулаты. Электрон согласно модели Н. Бора в атоме водорода вращается вокруг ядра, не излучая энергию, если на его орбите укладывается целое число длин волн де Бройля λ nλ = 2πrn, n = 1, 2, 3,... Разным разрешённым орбитам π соответствуют разные энергии электронов En
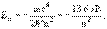 n = 1, 2, 3,... Радиус первой боровской орбиты атома водорода r1 ≈ 0.53·10-8 см. Электромагнитное взаимодействие электронов и атомных ядер определяет энергию связи и размеры атомов, размеры молекулярных структур.В пользу модели атома Бора свидетельствовали измеренные учеником Э. Резерфорда Г. Мозли длины волн характеристического рентгеновского излучения. Согласно модели Бора энергия электронов на первой боровской орбите атома должны быть пропорциональная квадрату заряда ядра
n = 1, 2, 3,... Радиус первой боровской орбиты атома водорода r1 ≈ 0.53·10-8 см. Электромагнитное взаимодействие электронов и атомных ядер определяет энергию связи и размеры атомов, размеры молекулярных структур.В пользу модели атома Бора свидетельствовали измеренные учеником Э. Резерфорда Г. Мозли длины волн характеристического рентгеновского излучения. Согласно модели Бора энергия электронов на первой боровской орбите атома должны быть пропорциональная квадрату заряда ядра

1)Эволюция представлений о строении атома. Открытие сложного строения атома – важнейший этап становления современной физики. В процессе создания количественной теории строения атома, позволившей объяснить атомные системы, были сформированы новые представления о свойствах микрочастиц, которые описываются квантовой механикой. Представление об атомах как неделимых мельчайших частицах веществ, как уже отмечалось выше, возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К началу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье (1743–1794), великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона (1766–1844) была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д.И. Менделеев, разработавший в 1869 г. периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. было экспериментально доказано, что электрон является одной из основных частей любого вещества. Первые косвенные подтверждения о сложной структуре атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Изучение свойств этих лучей привело к заключению, что они представляют собой поток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, близкой к скорости света. Особыми приемами удалось определить массу катодных частиц и величину их заряда, выяснить, что они не зависят ни от природы газа, остающегося в трубке, ни от вещества, из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов и превращены в электронейтральные частицы: электрический заряд составляет сущность их природы. Эти частицы, получившие название электронов, были открыты в 1897 г. английским физиком Дж. Томсоном. Изучение строения атома практически началось в 1897–1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Томсон предложил первую модель атома, представив атом как сгусток материи, обладающий положительным электрическим зарядом, в который вкраплено столько электронов, что превращает его в электрически нейтральное образование. В этой модели предполагалось, что под влиянием внешних воздействий электроны могли совершать колебания, т. е. двигаться ускоренно. Казалось бы, это позволяло ответить на вопросы об излучении света атомами вещества и гамма-лучей атомами радиоактивных веществ.В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Поскольку масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой. Предложенная Резерфордом схема строения атома или, как обыкновенно говорят, планетарная модель атома, легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов, поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.
2). Модель строения атома Бора. Планетарная модель атома, созданная Резерфордом, встретила полное недоумение, так как она противоречила казавшимся тогда незыблемыми основам физики. Нужно было как-то объяснить, почему вращающиеся вокруг ядра электроны не излучают энергию и не падают на атомные ядра. Большое значение в развитии представлений о строении атома сыграла модель Н. Бора, которая представляла собой введение квантовых условий в модель Резерфорда, построенную на основе классических представлений. В 1913 г. Н. Бор сформулировал свои знаменитые постулаты. Электрон согласно модели Н. Бора в атоме водорода вращается вокруг ядра, не излучая энергию, если на его орбите укладывается целое число длин волн де Бройля λ nλ = 2πrn, n = 1, 2, 3,... Разным разрешённым орбитам π соответствуют разные энергии электронов En
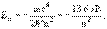 n = 1, 2, 3,... Радиус первой боровской орбиты атома водорода r1 ≈ 0.53·10-8 см. Электромагнитное взаимодействие электронов и атомных ядер определяет энергию связи и размеры атомов, размеры молекулярных структур.В пользу модели атома Бора свидетельствовали измеренные учеником Э. Резерфорда Г. Мозли длины волн характеристического рентгеновского излучения. Согласно модели Бора энергия электронов на первой боровской орбите атома должны быть пропорциональная квадрату заряда ядра
n = 1, 2, 3,... Радиус первой боровской орбиты атома водорода r1 ≈ 0.53·10-8 см. Электромагнитное взаимодействие электронов и атомных ядер определяет энергию связи и размеры атомов, размеры молекулярных структур.В пользу модели атома Бора свидетельствовали измеренные учеником Э. Резерфорда Г. Мозли длины волн характеристического рентгеновского излучения. Согласно модели Бора энергия электронов на первой боровской орбите атома должны быть пропорциональная квадрату заряда ядра

45. Атомные орбитали. Квантовые числа и их интерпритация. Строение многоэлектронных атомов. Атомная орбиталь — множество состояний электрона в атоме. Описывается с помощью совокупности квантовых чисел. В 1925 г. В. Паули был высказан принцип: в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел (принцип Паули). Исходя из принципа Паули можно определить количество электронов на каждой орбитали. Главное квантовое число Главное квантовое число n определяет общую энергию электрона на данной орбитали. Оно всегда целое, начиная с единицы, что связано с тем, что электрон в атоме может находиться лишь в определенных квантовых состояниях, соответствующих определенным значениям его энергии связи с ядром. Переход электрона из одного энергетического состояния в другое происходит скачкообразно, что позволяет говорить об энергетических уровнях электрона в атоме. Квантовое состояние атома с наименьшей энергией Е1 называют основным. В основном состоянии атом находится почти постоянно. В этом состоянии электрон наиболее прочно связан с ядром. Остальные квантовые состояния с более высокими уровнями энергии Е2, Е3, Е4, …, называют возбужденными. В возбужденном состоянии атом находится малые доли секунды. Возбуждение происходит при нагревании, под действием света, тока и так далее. При квантовых переходах электрона из одного состояния в другое меняется форма электронного облака: при уменьшении энергии связи с ядром облако увеличивается в объеме и наоборот. Орбитальное квантовое число Орбитальное квантовое число l описывает форму орбитали, а соответственно и форму электронного облака. Орбитальное квантовое число тоже натуральное, но не может быть больше значения главного квантового числа, уменьшенного на единицу. Имеются буквенные обозначения для орбитальных квантовых чисел: Таким образом, для электрона первого энергетического уровня (n = 1) возможна только одна форма орбитали, для второго энергетического уровня (n = 2) возможны две формы орбиталей, для третьего уровня (n = 3) — три и т. д. Согласно квантово-механическим расчетам s-орбитали имеют форму шара, р-орбитали — форму гантели, d- и f-орбитали — более сложные формы. Магнитное квантовое число Магнитное квантовое число описывает пространственное расположение орбиталей. Число значений магнитного квантового числа равно (2l-1), например, при l=1, m=-1,0,1. Орбитали с одинаковой энергией называются вырожденными. Таким образом, р-состояние вырождено трехкратно, d-состояние — пятикратно, а f-состояние — семикратно. Распределение электронной плотности Распределение электронной плотности относительно ядра изображают с помощью кривой радиального распределения вероятности. Электронная плотность по орбиталям распределяется неравномерно. Нулевые положения на кривой называются узлами. Они отвечают изменению знака волновой функции. Число максимумов на кривой распределения электронной плотности определяется главным квантовым числом. Для s-электронов число максимумов на кривой вероятности нахождения электрона равно значению главного квантового числа, для р-электронов — на единицу меньше, а для d-электронов — на две единицы меньше. Спиновое квантовое число Помимо формы облака и энергии электроны отличаются также спином. Для характеристики спина вводится спиновое квантовое число, которое принимает значения +1/2 и — 1/2. Квантовые числа и номенклатура орбиталей
Радиальное распределение плотности вероятности для атомных орбиталей при различных n и l.
- Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень):
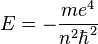
Энергия для n = ∞ соответствует энергии одноэлектронной ионизации для данного энергетического уровня.
- Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n — 1 (l = 0,1, …, n — 1). Момент импульса при этом задаётся соотношением
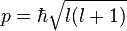
Атомные орбитали принято называть по буквенному обозначению их орбитального числа:
| Значение орбитального квантового числа | |||||
| Буквенное обозначение | s | p | d | f | g |
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
- Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от - l до l, включая 0 (ml = - l … 0 … l):

В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу ниже) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
1) Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда. Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается. Валентная оболочка — самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены). Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к т. н. валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами.
2). Принцип минимума энергии. Принцип минимума энергии отражает стремление любого атома находиться в основном (невозбужденном) состоянии. Принцип минимума энергии говорит лишь о вероятности направления превращения, но ничего не говорит о времени этого превращения. Камень на вершине холма может лежать тысячи лет, стальные орудия, закаленные сотни лет назад, сохраняют твердость и сейчас, так как неустойчивые закалочные структуры в стали при низких температурах имеют чрезвычайно малую, практически нулевую скорость превращения. Сухой порох может храниться десятки лет, пока не будет внесена начальная искра, инициирующая взрыв.Согласно принципу минимума энергии система тел находится в устойчивом равновесии тогда, когда свободная энергия системы лмеет наименьшую величину. Поэтому поверхностная энергия частиц высокой степени дисперсности имеет тенденцию к уменьшению. Это может быть достигнуто укрупнением частиц, связанным с уменьшением общей поверхности или путем концентрирования на поверхности частицы (молекул или ионов) другого вещества. Про-щесс концентрирования растворенного или парообразного вещества л (газа) на поверхности твердого вещества или жидкости называет - - ся сорбцией. Вещество, на котором идет сорбция, называется сорбентом, а сорбируемое вещество - сорбатом. Сорбция, происходящая на поверхности вещества, называется адсорбцией, а сопровождающаяся проникновением поглощаемого вещества внутрь поглотителя - абсорбцией. При этом поглощенное вещество называется сорбтивом.Чтобы применить принцип минимума энергии к расчету пластин, необходимо иметь выражение потенциальной энергии деформации пластины.В соответствии с принципом минимума энергии в молекуле водорода в основном состоянии связывающая МО заселена двумя электронами. При этом принцип Паули требует, чтобы эти электроны имели противоположные спины. Тогда молекула не имеет постоянного магнитного момента, что подтверждается экспериментально. Если пренебречь межъядерным и межэлектронным отталкиванием в молекуле, то очевидно, что энергия связи соответствует удвоенной разности энергий атомной орбитали Is и молекулярной орбитали МОСВ.Несмотря на то, что принцип минимума энергии подвергается сомнению и не дает точных результатов, действительное соотношение для угла сдвига должно быть выражено в сходной форме.В абзаце выше мы применили принцип минимума энергии к случаю состояния простого сдвига в упругой и идеально вязкой средах.Таким образом, мы получили принцип минимума энергии деформации, который утверждает следующее. Хп имеют такие значения, при которых энергия деформации минимальна.Эти методы, основанные на принципе минимума энергии, позволяют получать требуемый результат с достаточной степенью точности, однако вычисления остаются довольно сложными.Однако несмотря на то, что принцип минимума энергии у спешно применяется во многих областях исследований, обнаружилось, что его к поверхностным металлов приводит к ряду затруднений.Два электрона размещаются в соответствии с принципом минимума энергии и правилом Паули на сгсв - МО, имеющей низкую энергию, 7 - МО остается вакантной. Таким образом, представление о характере химической связи в молекуле На, полученное с использованием метода МО ЛКАО, оказывается аналогичным представлению метода ВС - связь образуется при помощи пары электронов, имеющих разные спиновые квантовые числа.Заселение орбиталей электронами происходит в соответствии с принципом минимума энергий, правилами Паули и Гунда
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1679; Нарушение авторских прав?; Мы поможем в написании вашей работы!