
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамический смысл энтропии
|
|
|
|
Второе начало термодинамики.
Первое начало термодинамики.
II. Основные законы термодинамики.
Первое начало говорит о возможности протекания процесса.
Теплота Q, подведенная к системе, идет на изменение внутренней энергии системы ΔU и совершение системой работы A.
Q = ΔU + A (1)
Первое начало в дифференциальной форме:
δQ = dU +δ A (2)
δQ, δA –зависят от вида процесса и не являются полными дифференциалами;
dU – зависит только от начального и конечного состояния и является полным дифференциалом.
Q>0 и δQ>0, если теплота подводится к системе, А >0, если работа совершается самой системой.
Второе начало термодинамики указывает направление процесса.
Качественные формулировки второго начала термодинамики:
- по Клаузиусу - «Невозможен процесс, единственным результатом которого была бы передача тепла от тела менее нагретого к более нагретому»;
- по Томсону - «Невозможен процесс, единственным результатом которого было бы совершение работы только за счет охлаждения одного тела».
Количественная формулировка второго начала термодинамики.
Существует такая функция состояния S – энтропия, элементарное изменение которой dS ≥ δQ/T (3). Знак «=» соответствует обратимым процессам, знак «>» соответствует необратимым процессам.
Обратимые процессы – такие, которые можно провести в прямом, а за тем и в обратном направлениях так, что после этого ни в системе, ни в окружающей среде не останется никаких изменений.
При необратимых процессах остаются изменения, которые нельзя скомпенсировать.
В изолированной системе δQ=0 и dS ≥0. Следовательно, энтропия остается постоянной (dS=0) при обратимых процессах и возрастает (dS>0) при необратимых процессах.
Энергия связи Wсвяз зависит от степени неупорядоченности молекулярного движения, а ее количественной мерой является температура Т. Степень неупорядоченности зависит также и от свойств самой системы, которые Клаузиус охарактеризовал коэффициентом пропорциональности S, названный энтропией.
Wсвяз =sT (4) => s= Wсвяз/T (5)
Энтропия – мера обесценивания энергии при необратимых процессах. В изолированной системе все процессы идут в направлении исчезновения градиентов (температуры, давления, потенциалов, концентрации) – градиентные процессы. П ротивоградиентные процессы – сопровождаются уменьшением энтропии, следовательно, не могут идти в изолированных системах.
Энтропия – физическая величина, характеризующая меру связанной энергии системы, приходящейся на единицу температуры (1 К).
Энтропия – функция состояния системы, поскольку целиком определяется параметрами системы и не зависит от того, как система пришла в данное состояние.
Изменение энтропии при элементарном обратимом процессе определяется выражением
ds =dQ/T (6)
При обратимом переходе из состояния (1) в состояние (2)
Δs= 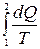 Q (7)
Q (7)
Для нахождения изменения энтропии при необратимом процессе, нужно рассмотреть какой либо обратимый процесс, приводящий систему в то же конечное состояние, и вычислить для этого процесса изменение энтропии.
Статистический смысл энтропии.
Энтропия – мера беспорядка в системе. По Больцману s=k ln Pтд (8), где k – постоянная Больцмана. Pтд – термодинамическая вероятность (число возможных микросостояний, которыми может быть реализовано данное макросостояние).
Второе начало термодинамики – это алгоритм, который дает возможность достоверно предсказать направление процессов в любом случае. Оно формулируется в следующем виде «при переходе из одного состояния в другое наиболее вероятным изменением энтропии является ее возрастание». Однако при флуктуациях протекают процессы, которые сопровождаются уменьшением энтропии, но эти малые отклонения от равновесного состояния не противоречат второму закону. Они являются неизбежным следствием именно вероятностного характера энтропии.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 3287; Нарушение авторских прав?; Мы поможем в написании вашей работы!