
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости реакции от концентрации
|
|
|
|
Химические реакции бывают простыми и сложными. Простыми (элементарными) называют реакции, протекающие в одну стадию. Сложными называют реакции, протекающие в несколько стадий.
Число частиц, участвующих в простой реакции или в отдельной стадии сложной реакции, называется молекулярностью. Простые реакции могут быть мономолекулярными, бимолекулярными и тримолекулярными. Если при бимолекулярной реакции концентрация одного из исходных реагентов значительно больше концентрации другого вещества, то в течение реакции концентрация вещества, взятого в избытке, остаётся практически неизменной. Подобные реакции называют псевдомономолекулярными.
Уравнение, связывающее скорость реакции с концентрациями реагирующих веществ, называется кинетическим.
Для простых реакций зависимость скорости от концентрации реагентов выражается законом действия масс: скорость реакции пропорциональна произведению молярных концентраций всех реагентов, взятых в степени их стехиометрических коэффициентов.
Для простой реакции
aA + bB = cC + dD
кинетическое уравнение имеет вид:
v = kc 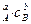 , (86)
, (86)
где сА, сВ – концентрации веществ А и В в данный момент времени, моль/дм3; k – коэффициент пропорциональности.
Сумма (a + b) равна молекулярности. Коэффициент пропорциональности k называется константой скорости химической реакции. Константа скорости представляет собой скорость реакции, когда концентрации всех исходных реагентов равны 1моль/дм3. Она не зависит от концентрации реагирующих веществ.
Сложная реакция состоит из нескольких стадий, и её скорость определяется скоростью самой медленной стадии – лимитирующей. Для параллельно протекающих реакций скорость определяется по наиболее быстрой из них.Скорость сложной реакции
aA + bB = cC + dD
также зависит от концентраций А и В, но характер этой зависимости может быть определен только опытным путём. Кинетическое уравнение для сложной реакции имеет вид:
v = kc 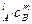 . (87)
. (87)
Величины l и m называют частными порядками реакции по веществам А и В, а сумма n = l + m – общий порядок реакции.
Порядок реакции – это сумма показателей степеней при концентрациях в кинетическом уравнении реакции.
Порядок сложной реакции может быть величиной как целой, так и дробной (0 ≤ n ≤ 3) и может быть найден только экспериментальным путём. Для простых реакций порядок совпадает с молекулярностью и может быть только целой величиной.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 481; Нарушение авторских прав?; Мы поможем в написании вашей работы!