
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ю.И. Категоренко 5 страница
|
|
|
|
В результате поверхностного проникновения металла в поры смеси на поверхности отливки образуется и удерживается после выбивки более или менее толстый слой пропитанной металлом формовочной смеси, иногда очень трудноудалимый. Этот поверхностный дефект отливок называют пригаром. Пригар, образуемый по описанному механизму, называется механическим пригаром.
Однако на практике чисто механический пригар образуется редко. В условиях окислительной атмосферы формы поверхность металла часто покрыта пленками окислов. Например, при литье железоуглеродистых сплавов важную роль играют окислы железа и марганца FeO и МпО. С кремнеземом песка эти окислы вступают во взаимодействие с образованием легкоплавких соединений типа файялита (2FeO×SiO2), родонита (MnO×SiO2), тефроита (2MnO×Si02) и др. С возникновением окисных или силикатных легкоплавких фаз проникновение сплава в поры смеси существенно облегчается. Окислы хорошо смачивают смесь и сами хорошо смачиваются металлом. Расплав идет за ними в капилляр как нитка за иголкой. Следует заметить, что окисные расплавы легко пропитывают поверхностный слой смеси, химически разрушая зерна песка. Иногда вместо зерен песка в пригарном слое обнаруживают монолитную массу, состоящую из указанных выше соединений. При этом образуется наиболее тяжелый вид пригара — химический. Из изложенного следует, что необходимой стадией химического пригара являются процессы, связанные с механическим пригаром. Схема образования пригарного слоя показана на рис. 1.41. К описанным выше процессам следует добавить процессы плавления наиболее легкоплавких составляющих смеси (окислы щелочных металлов, зерна полевого шпата, алюмосиликаты глины и т. п.) и их последующего спекания. Эти процессы характерны для так называемого термического пригара.
Все указанные виды пригара, как правило, сосуществуют. Пригарный слой представляет собой самостоятельную фазу, имеющую свою структуру. Этот слой удерживается на поверхности отливки не только за счет действия проникших в смесь прожилок металла, но и за счет адгезии, чему способствуют спекание слоя и структурные превращения в нем. Для уменьшения адгезии необходимо повысить межфазное натяжение на границе поверхность отливки — пригарный слой. В тех случаях, когда межфазное натяжение на этой границе мало, что имеет место при близких структурах металла и слоя, пригарный слой прочно удерживается на поверхности отливки силами адгезии.
Для примера можно привести неожиданный результат, полученный при освоении жидкостекольных смесей на УЗТМ в начале 50-х гг. Данные смеси, связующим в которых является силикат натрия или калия, содержат большое количество легкоплавких окислов щелочных металлов и поэтому отличаются большой пригораемостью. К удивлению технологов, смеси относительно легко были внедрены на стальном литье. При этом образовывался достаточно толстый слой пригара, который легко отскакивал от поверхности отливок при их очистке. В то же время на чугунном литье, несмотря на значительно меньшую, чем при стальном литье, температуру заливки, при применении жидкостекольных смесей образуется трудноудалимый от поверхности отливки пригарный слой. Минералогический и рентгеноструктурный анализ пригарного слоя показали, что при температурах, характерных' для литья чугуна, он имеет кристаллическую структуру, близкую к структуре металла. Это приводит к снижению межфазного натяжения на границе отливка — пригарный слой и, как следствие, к увеличению адгезии. При литье стали пригарный слой имеет вид аморфно-стекловидной массы, что приводит к увеличению межфазного натяжения и снижению адгезии.
Таким образом, поверхностные явления играют важную роль в пригарообразовании. Естественно, такой сложный процесс не исчерпывается только поверхностными явлениями. Комплексное рассмотрение пригарообразования — предмет технологических разделов спецкурса. С точки же зрения поверхностных явлений борьба с пригаром должна быть направлена на уменьшение как смачиваемости металлом материала формы, так и адгезии слоя к сплаву. Это может достигаться соответствующим подбором формовочных материалов, противопригарных покрытий, раскислением металла, предотвращением его окисления в форме, соответствующим легированием сплава и т. п.
Рассмотренные свойства жидких металлов и сплавов не охватывают всех их важнейших технологических характеристик. Мы не рассматривали механические свойства сплавов в жидком и двухфазном состояниях, теплоемкость жидких сплавов и их теплопроводность и другие свойства. Эти свойства металлов и сплавов будут рассмотрены в соответствующих разделах курса.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Что такое ближний и дальний порядок?
2. Какова основная причина плавления твердых тел?
3. Особенности теплового движения твердых, жидких и газообразных тел.
4. В чем причина объемного расширения тел в твердом состоянии?
5. Объемные изменения при плавлении тел.
6. Что такое радиальная функция распределения и корреляционная функция?
7. Каков смысл и вид радиальной функции распределения и корреляционной функции для газов, жидкостей и твердых тел?
8. Что такое кластер?
9. Зависимость вязкости металлов и сплавов от состава, температуры и давления.
10. Что такое реология?
11. Модель и поведение H -тела и N -тела.
12. Модель и поведение B -тела.
13. Модель и поведение сплава в интервале ликвидус — солидус,
14. Что такое адгезия и когезия?
15. Механизмы образования пригара.
16. Меры борьбы с пригаром.
17. Формулы для вычисления величины капиллярного давления.
18. Рассчитать температуру плавления алюминиевого шарика диаметром 0,0001 мм при следующих параметрах: равновесная температура плавления при плоской границе фаз Травн = 660°С; поверхностное натяжение (sт-ж = 860×10-3 Дж/м2; теплота плавления L = 418 кДж/кг; плотность r = 2710 кг/м3.
19. Найти координационное число для компактной гексагональной решетки.
20. Найти радиусы четырех первых координационных сфер для компактной гексагональной решетки и построить для нее график распределения числа атомов по координационным сферам.
21. Определить величину относительной деформации H -тела при сдвиге, если t = 300 МПа, E = 70 ГПа, m = 0,31.
22. Вывести формулу Пуазейля для вычисления средней скорости и расхода ньютоновской жидкости в цилиндрическом канале радиусом R при постоянном перепаде давлений ΔР. Во сколько раз возрастет расход, если радиус канала увеличить в 2 раза?
23. Построить график изменения деформации B -тела во времени при следующих исходных данных: t = 100 Mпа = const, ts = 60 МПа, h = 10 Н×с/м2, G = 1 ГПа. Какой будет деформация через 30 с?
24. Вычислить вязкость алюминиевого сплава, содержащего в 1 см3 2000 частиц радиусом 0,1 см, если вязкость чистого сплава h0 = 10-2 Н×с/м2.
25. Построить график изменения деформации тела Кельвина при t = 300 МПа, G = 1 ГПа, h = 10 Н×с/м2. Какой будет деформация через 30 с? По какой кривой идет уменьшение деформации при разгрузке?
Раздел 2. ОСНОВЫ ТЕОРИИ ФОРМИРОВАНИЯ КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ ОТЛИВОК
Среди литейных процессов центральное место занимает переход сплава из жидкого в твердое кристаллическое состояние. Этот процесс является фазовым переходом первого рода, связанным с изменением объема, теплосодержания и энтропии. При рассмотрении данного процесса можно выделить два аспекта: количественный и качественный. Количественный аспект составляет содержание теории затвердевания, главной задачей которой является разработка методов расчета кинетики выделения твердой фазы в объеме расплава. Качественный аспект направлен на рассмотрение вопросов формирования кристаллической структуры отливок и методов управления ею.
ГЛАВА 2.1. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ САМОПРОИЗВОЛЬНОЙ КРИСТАЛЛИЗАЦИИ МЕТАЛЛОВ И СПЛАВОВ
Современная теория формирования кристаллической структуры отливок.создана за последние 20 лет на основе творческого распространения элементарной теории кристаллизации металлов и сплавов на большие объемы неизотермически затвердевающих расплавов.
Жидкий металл переходит в твердое состояние в соответствии с общими законами термодинамики. Как известно, самопроизвольно протекают те процессы, в которых уменьшается свободная энергия и энергия Гиббса G. На рис. 2.1 приведены кривые изменения энергии Гиббса твердого и жидкого металла в зависимости от изменения температуры. Видно, что при температуре, большей Тпл, Gж < Gтв и устойчивым является жидкое состояние металла. При T < Tпл Gтв < Gж, поэтому устойчивым является твердое состояние. Температура Т = Tпл, при которой Gтв = Gж, называется температурой плавления. При равновесном процессе перехода из жидкого состояния в твердое эта температура соответствует равновесной температуре кристаллизации сплава Tкр. "При снижении температуры ниже Ткр возникает переохлаждение Δ T = Tкр — Т. Так как при этом Gж > Gтв, то создаются термодинамические предпосылки для перехода из жидкого состояния в твердое, т. е. для кристаллизации. Движущей силой этого процесса будет разность энергий Гиббса Δ G = Gж — Gтв. Преобразуем это выражение, прибавив и отняв энергии Гиббса жидкой и твердой фаз при T = Ткр.
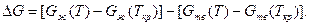
Так как Gж(Ткp) = Gтв(Ткр), то равенство при этой операции не нарушится. Поскольку реальные переохлаждения металлов не велики, то для стоящих в квадратных скобках выра-
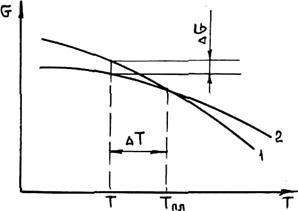
Рис. 2.1. Зависимость энергии Гиббса жидкого (/) и твердого (2) металла от температуры
жений можно написать следующие приближенные равенства:
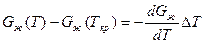 ,
,
 .
.
С учетом этого Δ G = — Δ Т(dGж/dТ — dGтв/dТ). Так как dG/dТ = —S, то Δ G = + Δ T×ΔS, где Δ S — изменение энтропии при плавлении металла. Как известно, Δ S = L/Tпл, где L— молярная теплота плавления, следовательно, Δ G = L×ΔT/Гкр. Из этого выражения видно, что с ростом переохлаждения движущая сила кристаллизации увеличивается.
Следует отметить, что при кристаллизации возникает новая фаза, имеющая физическую поверхность раздела с жидкостью. Поэтому кристаллизация связана с затратами энергии на образование и рост данной поверхности раздела фаз. Величина этой энергии равна Es = sк-ж×S, где sк-ж — межфазная энергия на границе раздела фаз; S — поверхность растущего кристалла. В результате образования кристалла объемом V с поверхностью S энергия системы уменьшится на величину Δ Gv и увеличится на величину Es. Поэтому изменение суммарной энергии Гиббса будет равно
 ,
,
где r и М— плотность твердого металла и его молярная масса. Анализ характера зависимости Δ Gå от объема кристалла V показывает, что она имеет экстремальный характер. Характер зависимостиΔ Gå от радиуса зародыша показан на рис. 2.2.

Кис. 2.2. Зависимость Δ Gå от радиуса зародыша r при разных температурах (T1>T2>Tкр>Т3>Т4)
В курсе металловедения получено следующее выражение для критического размера сферического зародыша, обеспечивающего максимум Δ Gå (читателю предлагается вывести его самостоятельно):
 .
.
Из рис. 2.2 видно, что с понижением температуры, т. е. с увеличением переохлаждения, радиус критического зародыша становится меньше (rкр2 < rкр1). При этом уменьшается и энергия образования критического зародыша.
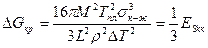 ,
,
где Esкр — поверхностная энергия зародыша критических размеров.
Пусть по каким-либо причинам в расплаве при данном переохлаждении возник зародыш радиуса r < rкр. Рост такого зародыша (увеличение r), как видно из рис. 2.2, сопровождается ростом Δ Gå. Поэтому данный зародыш не способен к росту и будет расплавляться. Если радиус зародыша r ³ rкр, то при присоединении к нему даже одного атома, т. е. с ростом его размеров, Δ Gå будет убывать. Поэтому данный зародыш сможет расти.
Центром кристаллизации будет называться зародыш, обязательно способный к росту. Критический зародыш (r = rкр) еще не является центром кристаллизации: он может потерять хотя бы одну частицу, т. е. стать дозародышем (r < rкр) и исчезнуть, или

Рис. 2.3. Зависимость вероятности Р1 флуктуации энергии Е от величины флуктуационного отклонения Δ Е
присоединить хотя бы одну частицу (r > rкр) и получить возможность для роста, т. е. стать центром кристаллизации. Поэтому вероятность образования центра кристаллизации равна произведению вероятностей образования зародыша критических размеров p1 и присоединения к нему частицы р2, т. е. p = p1× p2.
Вероятность образования центра кристаллизации равна отношению числа возникших в единицу времени в единице объема расплава центров кристаллизации п к общему числу частиц в расплаве N, т. е. p = n/N. Величина п, называемая скоростью возникновения центров кристаллизации (СВЦК), является важнейшей кристаллизационной характеристикой металлического расплава. Очевидно, n = p× N = p1× p2× N. Размерность [п] — м-3× c-1.
Для того чтобы определить вероятность p1, рассмотрим вопрос о причинах появления зародышей в условиях возрастания суммарной энергии Гиббса Δ Gå. С точки зрения статистической физики характерные для равновесия значения термодинамических величин представляют собой лишь наиболее их вероятные при данных условиях значения. Практически отдельные микрообъемы жидкости в течение некоторых малых промежутков времени могут обладать значениями термодинамических величин, отличными от отвечающих данному равновесному состоянию. При этом большую часть времени система обладает равновесными термодинамическими характеристиками. Случайные отклонения какой-либо величины от ее равновесного значения называются флуктуациями. Вероятность обнаружения флуктуации зависит от ее величины. Чем больше флуктуация, т. е. отклонение от соответствующего равновесного значения, тем она менее вероятна и тем меньшее время система обладает соответствующим отличным от равновесного значением той или иной величины. Следует отметить, что кривая зависимости вероятности флуктуации от ее величины отличается острым максимумом в области нулевых флуктуаций (рис. 2.3). Поэтому с увеличением флуктуации вероятность ее появления резко снижается до нуля.
Благодаря наличию флуктуации энергии в расплаве будет находиться то или иное количество микрообъемов, обладающее избытком энергии, необходимым для совершения работы образования зародыша критических размеров Δ Gкр. Вероятность такой энергетической флуктуации равна pl = nк/N = exp(— Δ Gкр/kТ), где nк — число зародышей критического размера; N— общее число частиц в единице объема. Вероятность p1 и будет вероятностью возникновения зародыша критического размера в единице объема в единицу времени. Очевидно, что, чем больше Δ Gкр, тем большая требуется энергетическая флуктуация и меньше вероятность р1. Так как с увеличением переохлаждения Δ T Δ Gкр уменьшается, то с ростом Δ Т повышается р1. Вероятность присоединения к зародышу хотя бы одной частицы равна p2 = nsen× exp(—U/kT), где n s— число атомов в жидкости, находящихся в контакте с поверхностью зародыша; e = l/6 — вероятность скачка атомов в данном направлении; n — частота колебаний атомов в жидкости (n = 1013•c-l); U— энергия активации диффузии атомов в жидкости, определяющая подвижность атомов.
Таким образом, вероятность образования центра кристаллизации равна
 . (2.1)
. (2.1)
С учетом формулы (2.1) для вычисления скорости возникновения центров кристаллизации можно записать выражение
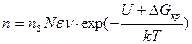 . (2.2)
. (2.2)
С увеличением переохлаждения Δ Gкр уменьшается, а U возрастает (снижается подвижность атомов). Поэтому зависимость п от Δ Т носит экстремальный характер (рис. 2.4). Подобную кривую получил впервые в начале века Г. А. Тамман при кристаллизации органических прозрачных жидкостей. Для чистых гомогенных металлических расплавов зависимость п от Δ T показана на рис. 2.5. Видно, что при переохлаждениях, меньших величины Δ Т1, называемой интервалом метастабильности по зарождению, зарождение центров кристаллизации практически не происходит. Для металлов ниспадающая ветвь кривой (см. рис. 2.4) не реализуется, так как подвижность атомов в металлах очень велика.

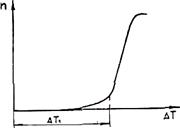
Рис. 2.4. Зависимость СВЦК " от переохлаждения ΔТ Рис. 2.5. Зависимость СВЦК от переохлаждения
для очистки гомогенных металлических расплавов
Для чистых гомогенных металлических расплавов величина интервала метастабильности очень велика. Расчеты показывают, что Δ T1» 0,2 Ткр. Реально подобная переохлаждаемость расплавов не наблюдается, так как в расплаве всегда находится достаточное количество примесей, инициирующих зародышеобразование.
Обычно самопроизвольную гомогенную кристаллизацию изучают на мельчайших каплях чистого металла. При этом считается, что при измельчении металла вероятность нахождения примеси в капле уменьшается. Зависимость n от Δ T для металлов можно аппроксимировать следующей степенной зависимостью: n = n0(ΔT — ΔT1)s, где показатель степени s находится в интервале от 1 до 3.
Выше речь шла о самопроизвольном зарождении кристаллов при затвердевании однокомпонентных расплавов (чистых металлов). Большинство литейных расплавов являются сплавами, т. е. высокотемпературными жидкими растворами. При этом продуктами кристаллизации чаще всего являются твердые растворы. При охлаждении до температуры ликвидуса жидкий сплав оказывается насыщенным по отношению к легирующему компоненту. Поэтому при дальнейшем снижении температуры наступает пересыщение и из расплава должны выделяться твердые кристаллы.
Свойства, не зависящие от количества вещества, называются интенсивными. К ним относятся температура и давление. Применительно к растворам Г. Н. Льюис ввел еще одну интенсивную величину, называемую парциально-молярной величиной компонента. Она представляет собой частную производную от какого-либо экстенсивного свойства W по числу молей этого компонента при постоянных давлении, температуре и числе молей остальных компонентов в растворе, т. е. qi = (дW/дni}p,T,n j¹i Например, парциально-молярная энергия Гиббса для (i -го компонента равна Gi = (дG/дпi)р,T, j¹i. Легко понять, что парциально-молярные свойства чистых веществ совпадают со значением этих свойств одного моля

Рис. 2.6. Схема графического определения состава фаз, находящихся в равновесии при заданной температуре
вещества для заданных условий (G0A и G0B). Действительно, для вещества A G = nG0A и дG/дп = G0A. Величина дG/дпi называется химическим потенциалом mi, т. е. mI = (дG/дпi)P,T, j¹i Химический потенциал характеризует тенденцию вещества покинуть данную фазу и перейти в другую. Физически химический потенциал равен работе, которую нужно совершить, присоединяя к раствору одну частицу данного компонента. Интенсивные величины Т, Р и mI характеризуют условия термического, механического и химического равновесия. Для равновесия необходимо, чтобы во всех фазах были одинаковые температуры, давления и химические потенциалы компонентов.
Приравняв величины mI для каждого компонента во всех фазах, получим систему уравнений, которая совместно с уравнениями материального баланса позволяет найти составы находящихся в равновесии фаз. Для двойных сплавов этот подход хорошо реализуется графически. На рис. 2.6 показан пример графического метода определения состава твердого раствора и находящейся с ним в равновесии при некоторой температуре Т жидкой фазы. При равновесии должны выполняться условия mтвА = mжА и mтвВ = mжВ, а если mВ = дG/дпв, то составы фаз должны обеспечивать выполнение равенства
 или
или 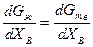
Геометрически это означает, что составы определяются общей касательной к кривым зависимости энергий Гиббса твердой и жидкой фаз при данной температуре. Эти равновесные составы GтвВ и GжВ показаны на рис. 2.6. Иногда считают, что искомые составы отвечают точкам пересечения кривых мольных энергий фаз, например точке А, т. е. точкам, где равны энергии фаз. Однако равновесные фазы обеспечивают минимум суммарной энергии обеих фаз, а он достигается только при mжА = mтвА и mжВ = mтвВ.
Таким образом, при достижении пересыщения из раствора могут выделяться твердые растворы, концентрации которых отличаются от исходной. При этом для начала процесса кристаллизации необходимо пересыщение раствора, достигаемое его переохлаждением относительно температуры ликвидуса.
Движущая сила, создающая условия для выделения твердой фазы в сплавах, определяется так же, как и для металлов, по изменению энергии Гиббса системы.
При кристаллизации сплавов вместо справедливого для однокомпонентного металла выражения Δ Gм = L× Δ T'/Tпл следует применять выражение Δ Gж-a С учетом этого для критического размера зародыша получим выражение rкр = 2sМ/(r× Δ Gмж-а). Работа образования критического сферического зародыша равна 16 pМ2s3/[ З r2( Δ Gж-а)2].
Следует отметить, что зарождение центров кристаллизации сплавов, как показали исследования, качественно описывается той же зависимостью от переохлаждения, что и у металлов. При этом переохлаждение отсчитывается от температуры ликвидуса. Величину Δ Gмж-a можно также вычислить по формуле L Δ T/Тл, где L — теплота кристаллизации, выделившаяся при кристаллизации единицы массы сплава при данной температуре.
Для образования зародышей твердых растворов необходимы не только рассмотренные выше энергетические флуктуации, но и флуктуации концентрации. Концентрационные флуктуации представляют собой участки растворов, состав которых отличается от среднего. Например, в жидком чугуне при средней концентрации углерода 3,4 % обнаруживаются участки размером 10-8 см, состоящие из одного углерода. По-видимому, именно эти участки являются основой возникновения зародышей графита при кристаллизации чугуна.
Рассмотренный выше процесс кристаллизации сплавов называется диффузионным, так как при кристаллизации в этих случаях происходит перераспределение компонентов между фазами путем диффузии.

Рис. 2.7. Схема бездиффузионной кристаллизации
Возможен бездиффузионный процесс кристаллизации сплавов, когда состав выделяющейся твердой фазы строго совпадает с составом исходного жидкого сплава. На рис. 2.7 представлена диаграмма состояния и зависимость G от состава для жидкого сплава и сплава в твердом состоянии. Зависимость G приведена при T = T1. Точка A` отвечает равенству мольных энергий Гиббса твердой и жидкой фаз. На диаграмме состояния ей соответствует точка А`. Если аналогичные точки перенести на диаграмму при других температурах, то получим линию EF, отвечающую равенству Gт = Gж. Если сплав резко переохладить ниже этой линии (например до T = T2), то Gт станет меньше Gж и произойдет бездиффузионная кристаллизация с выделением твердой фазы концентрации С0. Анализ показывает, что для этого нужны очень большие переохлаждения (порядка нескольких десятков и даже сотен.градусов) В обычной литейной практике они не достигаются, так как требуют очень больших скоростей охлаждения при малых объемах сплава.
ГЛАВА 2.2. ТЕОРИЯ ГЕТЕРОГЕННОГО ЗАРОДЫШЕОБРАЗОВАНИЯ
Большинство металлов затвердевает при значительно меньшем переохлаждении, чем максимальное переохлаждение Δ Tmах = 0,2Tкр предсказываемое теорией гомогенного образования зародышей. Это обусловлено наличием в расплаве инородных твердых частиц которые облегчают возникновение зародышей, Рассмотрим простейший случай образования зародыша на плоской поверхности включения.
Пусть зародыш ограничен частью сферической поверхности радиуса R (рис. 2.8). Изменение полной мольной энергии сплава при образовании зародыша в данном случае имеет вид
 ,
,
где s2-3 и s1-2 — межфазные энергии на границах сплав — зародыш и зародыш — включение; wсф и wвкл — площади поверхностей зародыша на границе со сплавом и на границе с включением; s1-3 — межфазная энергия на границе между включением и сплавом. Выполнив геометрические преобразования (предлагаем читателю выполнить их самостоятельно), получаем следующие формулы для вычисления V, wсф и wвкл:
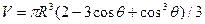 ;
;
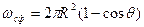 ;
;  .
.
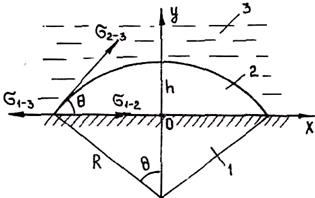
Рис. 2.8. Схема зарождения кристалла на плоской поверхности включения:
/ — включение; 2 — зародыш; 3 — сплав
Подставив эти выражения в формулу для Δ Gå и выполнив исследования на максимум, получаем следующие выражения для вычисления энергии образования критического зародыша на включении и соответствующего ему размера Rкр:
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 415; Нарушение авторских прав?; Мы поможем в написании вашей работы!