
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Современные технологии дистанционной лучевой терапии
|
|
|
|
Е) Лучевая терапия ускоренными электронами
Е) Ионы углерода
Ж) Искусственный радионуклид
Е) Аппарат для коротко-дистанционной рентгенотерапии
Ж) Лучевая терапия ускоренными электронами
Е) Лучевая терапия тормозным излучением высоких энергий
2) Какие методы лучевой терапии относят к контактным?
а) Аппликационный
б) Ортовольтная рентгенотерапия
в) Внутритканевой
г) Дистанционная гамма-терапия
д) Метод избирательного накопления изотопов
е) Лучевая терапия тормозным излучением высоких энергий
ж) Лучевая терапия ускоренными электронами
3) Какие аппараты для лучевой терапии называют генераторами ионизирующего излучения?
а) Дистанционные гамма-аппараты
б) Установки для ортовольтной рентгенотерапии
в) Гамма-терапевтический аппарат для внутриполостной лучевой терапии
г) Линейный ускоритель электронов
д) Бетатрон
4) Выбрать характеристики радионуклида 60Со в дистанционных гамма-терапевтических аппаратах.
а) Период полураспада 2,7 года
б) Энергия 125 КэВ
в) Слой половинного ослабления 12 мм свинца
г) Период полураспада 5,3 года
д) Энергия 1,25 МэВ
е) Слой половинного ослабления 12 мм меди
5) На каких аппаратах для лучевой терапии получают тормозное излучение высоких энергий и ускоренные электроны.
а) Дистанционный гамма-терапевтический аппарат
б) Рентгенотерапевтический аппарат
в) Линейный ускоритель электронов
г) Гамма-терапевтический аппарат для внутриполостной терапии
д) Бетатрон
е) Синхроциклотрон
6) Какие виды ионизирующего излучения используются при адронной терапии?
а) Электроны
б) Протоны
в) Альфа-частицы
г) Нейтроны
д) Позитроны
7) Какие виды лучевой терапии можно применять для лечения глубоко расположенных злокачественных опухолей?
а) Гамма-терапия 60Со
б) Коротко-дистанционная рентгенотерапия
в) Длинно-дистанционная рентгенотерапия
г) Лучевая терапия тормозным излучением высокой энергии
д) Лучевая терапия ускоренными протонами
е) Лучевая терапия ускоренными электронами
8) Какие виды лучевой терапии можно применять для лечения поверхностно расположенных злокачественных опухолей?
а) Гамма-терапия 60Со
б) Коротко-дистанционная рентгенотерапия
в) Длинно-дистанционная рентгенотерапия
г) Лучевая терапия тормозным излучением высокой энергии
д) Лучевая терапия ускоренными протонами
По мнению экспертов ВОЗ, успех лучевой терапии на 50% зависит от наличия современной радиотерапевтической аппаратуры, оборудования для компьютерного дозиметрического планирования процедур облучения и их последующего воспроизведения и на 50% от медицинского фактора (индивидуальные особенности организма, чувствительность опухоли к лучевой терапии, профессионализм медицинского персонала и др.
Существующие в настоящее время технологии дистанционного облучения можно условно иерархизировать следующим образом:
1. Конвенциальное облучение (conventional irradiation);
2. 3D конформное облучение (3-dimensional conformal irradiation);
3. Интенсивно модулированная радиотерапия (intensity-modulated radiation therapy - I MRT );
4. Радиотерапия под визуальным контролем (image guided radiation therapy - IGRT );
5. Стереотаксическая радиотерапия, радиохирургия (stereotactic radiation therapy/surgery, SRT/SRS).
Конвенциальное лучевое лечение базируется в основном на использовании сравнительно простых методик облучения пациентов. Обычный линейный ускоритель электронов или гамма-терапевтический аппарат создают прямоугольное радиационное поле тех или иных размеров при помощи металлических коллиматоров (иногда называемых «челюстями» - jaws), встроенных в аппарат. Для формирования фигурного поля, по контурам примерно соответствующего облучаемому опухолевому очагу, используют стандартные приспособления: защитные блоки, клиновидные фильтры, решетчатые диафрагмы и др. (рис. 4.6). Выбор центра и границ поля при планировании облучения осуществляется на основе проекционного изображения, полученного под заданным углом. Дозиметрический расчет плана лучевой терапии проводится на одном или, реже, нескольких поперечных срезах. Этот срез строится на основе поперечных компьютерных томограмм пациентов или проекционных снимков. Разработанная программа облучения после верификации плана на симуляторе реализуется на линейном ускорителе электронов или дистанционном гамма-аппарате.
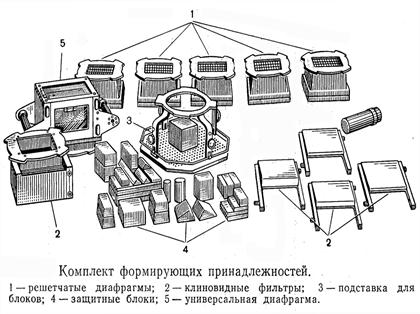
Рис. 4.6. Комплект формирующих принадлежностей для дистанционного гамма-терапевтического аппарата типа «РОКУС».
Понятие «конформная лучевая терапия» может быть определено как попытка придания объему высокой дозы формы опухоли при ограничении до минимума дозы на окружающие здоровые ткани. С клинической точки зрения - это «попытка обеспечить полное разрушение первичного очага без превышения толерантности нормальных тканей». (Gerald J. Kutcher).
При конформном радиационном воздействии для создания требуемой формы поля необходимы различные варианты фигурных блоков. Конформная лучевая терапия требует обязательного применения трехмерного планирования облучения. Дополнительное формирование пучка достигается использованием комбинации коллиматоров и специальных блоков (набор свинцовых блоков или блоков из свинцового сплава Вуда различных форм и размеров), помещенных и закрепленных на специальной подставке в проекцию прямоугольного поля, сформированного стандартным коллиматором. Блоки перекрывают части прямоугольного поля вне объема мишени и защищают здоровые ткани за границами мишени. Современные линейные ускорители оснащены многолепестковым коллиматором (МЛК), сформированным из 48-120 экранирующих пластинок, способных создавать поля облучения любой конфигурации (рис. 4.7.).

Рис. 4.7. Многолепестковый коллиматор. 54 лепестка формируют поле облучения, соответствующее очертаниям опухоли.
Регулировка конфигурации поля осуществляется посредством изменений в компьютерном файле, содержащем установки для лепестков.
МЛК может быть использован в радиотерапии с тремя целями.:
1. Альтернатива обычному (конвенциальному) формированию поля при помощи блоков.
2. Функция МЛК является расширением первой. При этом происходит непрерывная регулировка формы поля, чтобы следовать необходимой конфигурации поля в проекции запланированного объема мишени в процессе перемещения пучка при облучении.
3. Применение МЛК – использование его для реализации модуляции интенсивности пучка, т.е. интенсивно-модулированной радиотерапии (IMRT).
Для осуществления модуляции разработаны различные подходы, регулирующие движение лепестков МЛК во время облучения, что создает динамический компенсирующий фильтр, обеспечивающий облучение при нескольких фиксированных положениях консоли, либо в случае непрерывно вращающегося веерного или конического пучка. Лепестки обязаны давать приемлемый уровень ослабления, должны иметь оптимальные характеристики для задания формы поля при работе во всем диапазоне размеров полей и полностью вписываться в остальную коллимирующую систему.
Для определения расположения лепестков применяют различные типы датчиков. Наиболее часто в многолепестковых коллиматорных системах используют высокоточные потенциометры. Преимущества таких линейных датчиков положения состоят в простоте сбора информации, меньшей подверженности повреждениям от радиации, хорошей линейности и точности. Недостаток – необходимость подведения проводки к каждому из них, и, как следствие, большое пространство в облучающей головке ускорителя должно быть выделено для этого.
Для распознавания положения лепестка видеооптическая система использует тот же источник света, что и для позиционирования пациента. Обратный рефлектор монтируется вблизи конца каждого лепестка. Свет, проецирующийся на конец лепестка, отражается назад вдоль той же траектории, что и исходный свет. Расщепитель пучка и канал системы зеркал отражают свет на твердотельную камеру.
Формируется изображение, демонстрирующее положение рефлекторов. Изображение может быть построено так, чтобы камера показывала только рефлекторы. Видеосигнал оцифровывается и обрабатывается процессором изображений в контроллере МЛК. Поскольку все рефлекторы имеют одинаковую форму и размер, можно использовать простую технику распознавания позиции всех рефлекторов. В МЛК, которые предусматривают двухмерное изменение формы поля, для перемещения лепестков используются электрические двигатели. Эксперты американского общества терапевтической радиологии и онкологии (ASTRO) и Американской ассоциации медицинских физиков (ААРМ) считают (2004 г.), что интенсивно модулированная радиотерапия сегодня представляет собой самую перспективную технологию дистанционного облучения. ИМРТ дает возможность создавать не только радиационное поле любой требуемой формы, но и осуществлять облучение во время одного и того же сеанса с различной интенсивностью.
В современных линейных ускорителях для отображения пучка в реальном времени используется система портальной визуализации – Portal vision Система может использоваться при любом положении линейного ускорителя (рис. 4.8.).

Рис. 4.8. Использование системы портальной визуализации для верификации конфигурации пучка в режиме реального времени. Изображение может быть получено при любой ориентации поля.
Система портальной визуализации позволяет получить изображение облучаемой области в мегавольтном пучке, делать верификационные снимки и проводить мониторинг в процессе лучевого лечения (рис. 4.9.).

Рис. 4.9. Портальные снимки в процессе проведения лучевого лечения рака легкого.
Использование IMRT в клинике требует абсолютно обязательного выполнения ряда условий, к которым относятся:
· наличие корректного изображения первичной опухоли и окружающих ее структур, полученного с помощью лучевых методов диагностики;
- учет возможного физиологического движения мишени (опухоли) и других органов;
- жесткая иммобилизация пациента на лечебном столе радиотерапевтического аппарата.
В принципе для получения адекватного изображения, пригодного для дальнейшего трехмерного планирования, могут быть использованы четыре типа установок.
Симулятор – это рентгенодиагностический аппарат, специально приспособленный для выбора контуров (границ) радиационного поля. Данная функция с успехом может быть осуществлена также с помощью более усовершенствованных РКТ-симулятора (рентгеновского компьютерного томографа с функцией симулятора) и симулятора-РКТ. Но качество компьютерных томограмм, совершенно необходимых для планирования, у симулятора-РКТ значительно уступает таковому у РКТ-симулятора и стандартного диагностического РКТ. Это происходит из-за того, что на симуляторе-РКТ доступен меньший объем диагностической информации.
Полным набором требуемых функций обладает только РКТ-симулятор. Этот прибор имеет одну или несколько соединенных в сеть рабочих станций для трехмерной реконструкции и виртуальной симуляции, лазерную маркировочную систему. Его применение ограничивает высокая стоимость.
Для иммобилизации на лечебном столе ЛУЭ используется ряд приспособлений. Обычно на стол накладывается специальная планка из карбонового волокна, которая в сочетании с применением термопластических материалов дает возможность сохранять одно и то же положение пациента в течение всего времени проведения радиотерапии (Рис. 4.10.).

Рис. 4.10. Фиксация больной злокачественным заболеванием головного мозга с помощью термопластиковой маски
Дальнейший прогресс в развитии технологии IMRT неразрывно связан с интеграцией симулятора (рис. 4.11.) (киловольтного рентгеновского источника и детектора большой (41х 41 см²) площади в виде плоской панели) в ЛУЭ для осуществления флюороскопии, радиографии и объемной компьютерной томографии конусным пучком.
Рентгеновская трубка питается от высокочастотного рентгеновского генератора напряжением 45 кВ, работающим под контролем компьютера. Она монтируется на выдвижном кронштейне, который тянется от структуры барабана ускорителя. Фокусное пятно трубки располагается на 900 относительно мегавольтного источника и в 100 см (± 0,2 см) от поворотной оси ускорителя. Трубка имеет общую ось вращения с мегавольтным источником. Плоская панель рентгеновского детектора смонтирована напротив киловольтной трубки. Детектор обладает рядом характеристик, которые делают его идеально подходящим для компьютерной томографии конусным пучком, включая поперечные сечения на интенсивном рентгеновском излучении и эффективный, не подверженный искажениям, сбор данных.
Система получения изображения в целом работает под компьютерным управлением, засветка рентгеновским излучением и сбор информации с детекторов синхронизируется при помощи программного обеспечения.


Рис.4.11. Линейные ускорители с интегрированной позиционирующей рентгеновской системой (в ускорителях VARIAN система носит название OBI, on-board imager).
Геометрическая перекрестная калибровка систем получения изображения и приложения дозы позволяет создать объемное изображение в рамках координатной системы лечебного аппарата. Такой подход дает гибкость при разработке стратегии получения изображения в зависимости от специфики лучевой процедуры – будь то флюороскопия в реальном времени, рентгенография, компьютерная томография конусным пучком, либо комбинация всех трех перечисленных вариантов. Метод конусного пучка позволяет реконструировать компьютерно-томографическое изображение на основе данных, собранных за один поворот консоли. В такой ситуации мы фактически имеем дело с высоко интегрированной моделью, в которой система управления ЛУЭ гармонично сочетает взаимодействие компонента для получения изображения и реализации лучевого воздействия на едином радиотерапевтическом аппарате, предоставляющем возможность проводить высокоточное лучевое лечение, корректируемое по изображениям (IGRT). Следовательно, в данном случае речь идет об использовании в клинической практике ЛУЭ, позволяющем осуществлять неразрывный процесс идентификации мишени, мониторинга в реальном времени и эффективного приложения дозы.
Известно, что эффективность лучевой терапии находится в прямой зависимости от подведенной дозы. Конформное, интенсивно-модулированное облучение позволяет подвести суммарные очаговые дозы (СОД), значительно превышающие те значения, которые в эпоху конвенциональной лучевой терапии считались предельными из-за высокого риска повреждения здоровых тканей. Но поскольку опухоли некоторых локализаций могут смещаться в течение сеанса облучения вместе с движущимся органом, это серьезно осложняет задачу радиационного онколога. При использовании стандартных методик конформного облучения он вынужден расширять радиационное поле для исключения выхода опухоли за его пределы, существенно увеличивая риск радиационного повреждения здоровых тканей. При раке легкого для решения этой проблемы предложены различные решения. В частности, это интегрированные в ускоритель приборы для активного контроля за дыханием (Real-time Position Management – RPM respiratory gating), система задержки дыхания (Active Breathing Coordinator) и другие.
Стереотаксическая радиохирургия (SRS) - методика лучевой терапии, сочетающая принципы стереотаксиса (3D локализации мишени) с использованием множества сходящихся в одной точке лучей от высокоэнергетического источника излучения, осуществляемая за один сеанс (одну фракцию). Как правило, подводится доза не менее 15 Гр. Термин радиохирургия введен шведским нейрохирургом Л. Лекселлом (L. Leksell).Он означает разрушение выбранной зоны-цели в мозге, используя высокоточную доставку одиночной, высокой дозы радиации через интактный череп. В 1951 году Л. Лексел и биофизик Б. Ларсонсконструировали первый гамма-нож.
Гамма-нож (Gamma-Knife) (рис. 4.12) - это аппарат для проведения высокоточного одномоментного облучения различных патологических образований головного мозга. В основу положен метод стереотаксического наведения излучения на облучаемый объект.

Рис. 4.12. Аппарат «Гамма – нож»
Облучение проводится с помощью 201 сфрокусированного источника 60Со.Голова с установленной стереотаксической рамой жестко закреплена в автоматической позиционирующей системе (АРС). Створки аппарата открываются и ложе продвинется так, что голова окажется внутри «Гамма – ножа» (рис. 4.13).

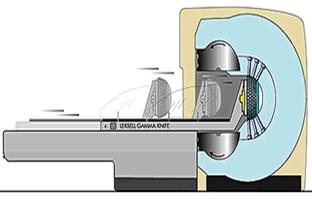
Рис. 4.13. Автоматическая позиционирующая система (слева) и схема ее продвижения с пациентом вовнутрь «Гамма-ножа».
Стереотаксическая радиохирургия на аппарате «Гамма-нож» применяется при лечении патологических образований в головном мозге размером до 30 мм.
Стереотаксическое облучение выполняют и на современных ускорителях с высокой мощностью тормозного пучка излучения и системами для коллимации и контроля (рис. 4.14.).


Рис. 4.14. Системы коллимации пучка и приспособления для стереотаксического облучения
Кибернож (CyberKnife) (рис. 4.15) -разработан в Стендфордском университете (США) в 1992 году под руководством профессора Джона Адлера.

Рис. 4.15. Линейный ускоритель «Кибернож».
Компактный линейный ускоритель установлен на контролируемом компьютером манипуляторе - роботе имеющем 6 степеней свободы доступа к мишени. Система контроля по изображению, использующая цифровые рентгеновские камеры, определяет местоположение опухоли и сравнивает новые данные с хранящейся в памяти информацией.При обнаружении смещения опухоли роботизированная рука корректирует направление пучка фотонов. Процессы контроля и нацеливания повторяются перед доставкой каждого пучка фотонов.Сотни пучков фотонов направляются точно в мишень. На аппарате «Кибернож» возможно проводить радиохирургическое лечение патологических образований, расположенных в любой части тела, что создает преимущество этого устройства перед гамма-ножом. В то же время, для киберножа также существует ограничение по объему облучаемой мишени – не более 3 см в диаметре.
В настоящее время большое значение придается интраоперационной лучевой терапии (ИОЛТ), т.е. облучению во время проведения оперативного вмешательства. Это методика, заключающаяся в однократном облучении ложа прооперированной опухоли, позволяет значительно снизить вероятность ее рецидива. Благоприятное распределение дозы излучения, а также правильный выбор мишеней позволяют добиться максимального повреждения микроскопических остатков опухоли при минимальном радиационном повреждении нормальных тканей.
Преимущество комбинации хирургического вмешательства с ИОЛТ доказано в рандомизированных исследованиях на моделях рака желудка, сарком мягких тканей, некоторых других злокачественных опухолей с установленным неблагоприятным прогнозом.
Учитывая потребность клиник в специальном оборудовании для осуществления ИОЛТ, были предложены интересные разработки. В частности, Inraop Medical создала аппарат «MOBETRON», генерирующий пучки электронов 4 МэВ, 6 МэВ, 9 МэВ и 12 МэВ, оснащенный рядом аппликаторов, болюсов и других приспособлений. Компания «Карл Цейсс» (Германия) предлагает применять при ИОЛТ установку «INTRABEAM PRS» (Рис. 4.16), снабженную рядом аппликаторов сферической формы диаметром от 1,5 до 5 см.


Рис. 4.16. Установка для ИОП «INTRABEAM PRS» с аппликаторами.
Прибор представляет собой миниатюрный линейный ускоритель, в котором пучок электронов направляется на золотую пластинку диаметром 3 мм, находящуюся внутри сферического аппликатора. В результате получается вторичное низкоэнергетическое (30-50 кВ) рентгеновское излучение. Благодаря соответствующей форме аппликаторов оно становится сферическим, изотропным. Особенно удобно использование данного прибора в целях ИОП во время выполнения органосохраняющих вмешательств у больных раком молочной железы, но с его помощью можно проводить ИОП и при колоректальном раке, раке поджелудочной железы, кожи, опухолях головы и шеи.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 4216; Нарушение авторских прав?; Мы поможем в написании вашей работы!