
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 7. Химические концепции описания природы
|
|
|
|
Основные космологические теории эволюции Вселенной.Учение о мегамире как едином целом и всей охваченной астрономическими наблюдениями области Вселенной (Метагалактике) называется космологией.
Выводы космологии основываются на законах физики и астрономии. Построенные в соответствии с космологическими теориями модели должны допускать проверку для наблюдаемой области Вселенной, выводы теории – подтверждаться наблюдениями теория – предсказывать новые явления. В конце XX в. этому требованию наилучшим образом удовлетворяли разработанные на основе общей теории относительности одно
родные изотропные модели нестационарной «горячей» Вселенной.
Возникновение современной космологии связано с созданием релятивистской теории тяготения А. Эйнштейном (1916) и зарождением внегалактической астрономии (начиная с 20-х гг. XX в.). На первом этапе развития релятивистской космологии главное внимание уделялось геометрии Вселенной кривизна четырехмерного пространства-времени и возможная замкнутость Вселенной.
Начало второго этапа можно датировать работами А.А. Фридмана, который в 1922–24 гг. доказал, что Вселенная, заполненная тяготеющим веществом, не может быть стационарной – она должна расширяться или сжиматься; но эти принципиально новые результаты получили признание лишь после открытия красного смещения (эффекта «разбегания» галактик) астрономом Э. Хабблом(1929). В результате на первый план выступили проблемы механики Вселенной и ее «возраста» (длительности расширения).
Третий этап в развитии космологии связан с моделями «горячей» Вселенной (Г. Гамов, вторая половина 40-х гг.), в которых основное внимание переносится на физику Вселенной – состояние вещества и физические процессы, идущие на разных стадиях расширения Вселенной, включая наиболее ранние стадии, когда состояние было необычным. В основе теории уравнения А. Эйнштейна общей теории относительности, из них следуют наличие кривизны пространства-времени и связь кривизны с плотностью вещества. Космологические уравнения допускают существование двух моделей. В одной из кривизна трехмерного пространства отрицательна или (в пределе) равна нулю. Вселенная бесконечна (открытая модель). В такой модели расстояния между скоплениями галактик со временем неограниченно возрастают. В другой модели кривизна пространства положительна, Вселенная конечна (но столь же безгранична, как и в открытой модели). В такой (замкнутой) модели расширение со временем сменяется сжатием. В ходе эволюции Вселенной кривизна трехмерного пространства уменьшается при расширении, увеличивается при сжатии, но знак кривизны не меняется, т.е. открытая модель остается открытой, замкнутая – замкнутой. Начальные стадий эволюции по обеим моделям совершенно одинаковы: должно было существовать особое начальное состояние – сингулярность с огромной плотностью массы и кривизной пространства и взрывное, замедляющееся со временем расширение.
Из космологических уравнений следует, что равная нулю кривизна пространства может иметь место только при строго определенной критической плотности ρкр.
Если  , то мир замкнут, при
, то мир замкнут, при  мир является открытым. Два указанных исходных положения достаточны для суждений об общем характере эволюции Вселенной, но они оставляют открытым вопрос о ее начальном состоянии.
мир является открытым. Два указанных исходных положения достаточны для суждений об общем характере эволюции Вселенной, но они оставляют открытым вопрос о ее начальном состоянии.
С 60–70-х гг. XX в. стала общепринятой модель «горячей» Вселенной (предполагается высокая первоначальная температура). В условиях очень высокой температуры (Т > 1013 К) существовала лишь равновесная смесь различных элементарных частиц (включая фотоны и нейтрино). Можно рассчитать состав такой смеси при разных температурах Т, соответствующих последовательным этапам эволюции, найти закон расширения однородной и изотропной Вселенной и изменение ее физических параметров в процессе расширения.
Согласно этому закону во Вселенной в момент 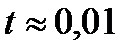 с должны были существовать фотоны, электроны, позитроны, нейтрино, антинейтрино, а также большая примесь нуклонов (протонов и нейтронов). В результате последующих превращений к моменту
с должны были существовать фотоны, электроны, позитроны, нейтрино, антинейтрино, а также большая примесь нуклонов (протонов и нейтронов). В результате последующих превращений к моменту 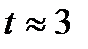 мин из нуклонов образовалась смесь легких ядер (2/3 водорода и 1/3 гелия по массе; все остальные химические элементы синтезировались из этого дозвездного вещества, причем намного позднее, в результате ядерных реакций в недрах звезд). В момент образования нейтральных атомов гелия и водорода (рекомбинация нуклонов и электронов в атомы произошла при
мин из нуклонов образовалась смесь легких ядер (2/3 водорода и 1/3 гелия по массе; все остальные химические элементы синтезировались из этого дозвездного вещества, причем намного позднее, в результате ядерных реакций в недрах звезд). В момент образования нейтральных атомов гелия и водорода (рекомбинация нуклонов и электронов в атомы произошла при  лет) вещество становилось прозрачным для оставшихся фотонов, и они должны наблюдаться в настоящее время в виде реликтового излучения, свойства которого можно предсказать на основе теории «горячей» Вселенной.
лет) вещество становилось прозрачным для оставшихся фотонов, и они должны наблюдаться в настоящее время в виде реликтового излучения, свойства которого можно предсказать на основе теории «горячей» Вселенной.
Наибольшее принципиальное значение этой теории имеют выводы о нестационарности (расширении) Вселенной, о высоких значениях плотности и температуры в начале расширения («горячая» Вселенная) и об искривленности пространства-времени.
Вывод о нестационарности надежно подтвержден космологическим красным смешением, обнаруженным Э. Хабблом в 1929 г.: наблюдаемая область Вселенной расширяется, и это расширение длится, по меньшей мере, 15—20 млрд. лет. Столь же основательное подтверждение нашла и концепция «горячей» Вселенной: в (1965) американскими физиками А.А. Пензиасом и Р.В. Вильсоном было открыто реликтовое излучение, которое оказалось изотропным, а спектр его – равновесным с Т = 3 К.
Что касается плотности вещества, то астрономические наблюдения приводят к значениям усредненной плотности вещества, входящего в видимые галактики,  г/см3. Определить плотность скрытого (невидимого) вещества, а тем более плотность, создаваемую нейтрино (если масса нейтрино не равна нулю), гораздо труднее, и неопределенность суммарной плотности из-за этого весьма велика. На основе имеющихся наблюдательных данных (10–31 < ρ < 10–29 г/см3) нельзя сделать окончательного выбора между открытой (расширяющейся безгранично) и замкнутой (расширение в далеком будущем сменится сжатием) моделями. Эта неопределенность никак не сказывается на общем характере прошлого и современного расширения, но влияет на возраст Вселенной (длительность расширения).
г/см3. Определить плотность скрытого (невидимого) вещества, а тем более плотность, создаваемую нейтрино (если масса нейтрино не равна нулю), гораздо труднее, и неопределенность суммарной плотности из-за этого весьма велика. На основе имеющихся наблюдательных данных (10–31 < ρ < 10–29 г/см3) нельзя сделать окончательного выбора между открытой (расширяющейся безгранично) и замкнутой (расширение в далеком будущем сменится сжатием) моделями. Эта неопределенность никак не сказывается на общем характере прошлого и современного расширения, но влияет на возраст Вселенной (длительность расширения).
Модель расширяющейся Вселенной. Вселенная – место вселения человека, доступное эмпирическому наблюдению. Постепенное сужение научного значения термина Вселенная вполне понятно, так к естествознание, в отличие от философии, имеет дело только с тем, что эмпирически проверяемо современными научными методами. Вселенную в целом изучает наука, называемая космологией, т. е. наукой о космосе. Космология, в основе своей открывает упорядоченность нашего мира и нацелена на поиск законов его функционирования. Открытие этих законов есть цель изучения Вселенной как единого целого.
Все законы и научные теории являются моделями, поскольку они могут быть заменены в процессе развития науки другими концепциями.
Наиболее общепринятой в космологии является модель однородной изотропной нестационарной горячей расширяющейся Вселенной, созданной А. Эйнштейном в 1916 году. В основе этой модели лежат два предположения: свойства Вселенной одинаковы во всех ее точках и направлениях; наилучшим известным описанием гравитационного поля являются уравнение Эйнштейна. Из этого следует кривизна пространства и связь кривизны с плотностью массы (энергии). Важным пунктом данной модели является ее нестационарность. Это определяется двумя постулатами теории относительности: принципом относительности, гласящим, что во всех инерционных системах выполняются все законы сохранения вне зависимости от того, с какими скоростями, равномерно прямолинейно движутся эти системы друг относительно друга; экспериментально подтвержденным постоянством скорости света.
Красное смещение – это понижение частот электромагнитного излучения: в видимой части спектра линии смещаются к его красному концу. При излучении происходит «покраснение», т. е. линии спектра сдвигаются в сторону более длинных (красных) волн. Для всех далеких источников света красное смещение было зафиксировано, причем, чем дальше находился источник, тем в большей степени. Красное смещение оказалось пропорционально расстоянию до источника, что и подтверждало гипотезу об удалении их, т. е. о расширении Метагалактики –видимой части Вселенной. Составной частью модели расширяющейся Вселенной является представление Большом Взрыве, происшедшем где-то примерно 12 –18 млрд. лет назад, по обоснованным оценкам, 13 млрд. лет.
Современная квантовая механика допускает (это не противоречит теории), что вакуум может приходить в «возбужденное состояние», вследствие чего в нем может образоваться поле, а из него (что подтверждается современными физическими экспериментами) – вещество. Рождение Вселенной «из ничего» означает с современной научной точки зрения самопроизвольное возникновение из вакуума, когда в отсутствии частиц происходит случайная флуктуация, которая представляет собой появление виртуальных частиц, которые непрерывно рождаются и сразу же уничтожаются, но так же участвуют во взаимодействиях, как и реальные частицы. Благодаря флуктуациям, вакуум приобретает особые свойства, проявляющиеся в наблюдаемых эффектах.
После Большого Взрыва образовался сгусток плазмы «состояния, в котором находятся элементарные частицы» нечто среднее между твердым и жидким состоянием, который и начал расширяться все больше и больше под действием взрывной волны.
Химия – наука о веществах и процессах их превращения, сопровождающие изменением состава и структуры.
Основанием химии выступает проблема получения веществ с заданными свойствами (производственная задача) и выявление способов управления свойствами веществ (научная задача). Свойства веществ зависят от: элементарного и молекулярного состава; структуры молекулы; термодинамических и кинетических условий процесса химической реакции; уровня химической организации вещества.
Концептуальные этапы получения знаний по химии можно представить следующим образом: XVII – учение о составе вещества; середина XIX в. – учение о структуре вещества; конец XIX в. – учение о химических процессах; середина XX в. – учение о химической эволюции.
Четыре способа решения основной проблемы химии:
Первый уровень научных химических знаний, продолжающийся с работ Р. Бойля (1660-е годы) до 1820-1830-х годов: свойства вещества определяются его составом. Химический элемент и химическое соединение. Дальтониды – химическое вещество молекулярного строения и бертоллиды – соединения немолекулярного строения. Вовлечение новых химических элементов в производство материалов. Синтез новых элементоорганических соединений, например фторорганических, обладающих исключительной устойчивостью.
Второй уровень развития химических знаний (середина XIX века): свойства вещества и их качественное разнообразие обуславливаются составом и структурой молекул. Возникновение структурной химии: работы Д. Дальтона, И.Я. Берцелиуса, Ш. Жерара, А. Кекуле, A.M. Бутлерова. Триумфальный марш органического синтеза. Пределы и проблемы структурной органической химии.
Третий уровень химических знаний (середина XX века): учение о химических процессах и механизмах изменения вещества. Свойства вещества зависят от термодинамических и кинетических условий, в которых вещество находится в процессе химической реакции. Учение о химических процессах – область науки, где осуществляется глубокое взаимопроникновение физики, химии и биологии. Химическое производство синтетических материалов.
Принципиальная обратимость всех химических реакций. Законы Я. Вант-Гоффа и А. Ле-Шателье. Зависимость хода химических процессов от структурно-кинетических факторов: от строения исходных реагентов, концентрации, наличия катализаторов и др. Проблемы катализа химических реакций и решение задачи химического преобразования ядерной и солнечной энергии.
Химия экстремальных состояний, высокотемпературный синтез. Четвертый уровень химических знаний (с 1970-х годов): свойства вещества зависят от высоты химической организации вещества. Биологизация химии – возникновение эволюционной химии. Основа лаборатории живого организма – биокатализ. Подражание живой природе – химия будущего. Создание катализаторов по принципу ферментов. Изучение брожения – один из первых опытов изучения химии живой природы. Пути освоения каталитического опыта живой природы: исследование в области металлокомплексного катализа, моделирование биокатализаторов, исследования в области иммобилизованных систем, применение принципов биокатализа в химической технологии.
Развитие учения о составе вещества. Демокрит иЭпикурсчитали, что все тела состоят из атомов различной величины и формы, чем и объясняли различие тел.
Аристотельи Эмпедоклвидимое разнообразие тел природы объясняли посредством сочетания в телах различных стихий: тепла и холода, сухости и влажности. Переход одних веществ в другие, связанный с появлением их новых специфических свойств и «форм». В эпоху эллинизма (до н.э.) возникло учение о «трансмутации»(превращении), согласно которому можно, изменяя сочетание элементов, получать вещество с иными свойствами. Так, пытались получить золото из более распространенных металлов – ртути, свинца и др. Главной целью алхимия считала поиски «философского камня» для превращения неблагородных металлов в благородные, получение эликсира долголетия, универсального растворителя и др.
В VIIIв. широкое распространение в Западной Европе получила «ртутно-серной» теории алхимиков, согласно которой вначале образуется «сера» из огня из воздуха и «ртуть» из земли и воды, а уже из них получаются различные металлы.
Т. Парацельс, в отличие от алхимиков, подчеркнул вещественный характер трех начал: «серы» – начала горючести, «ртути» – начала летучести, «соли» – начала огнепостоянства. Он ставит задачу исследовать свойства веществ и найти новые соединения с более полезными для медицинских целей свойствами, чтобы помогать человеку от болезней, успешно применял препараты ртути против сифилиса. Вскоре медицинскую химию (иатрохимию) стали преподавать на медицинских факультетах университетов.
Научное изучение химических явлений начинается в 1600 г. с работ Р. Бойля.Он создает теорию, по которой окружающий нас мир построен из мельчайших частичек – корпускул, различных по размерам, форме и массе. Они, объединяясь и разъединяясь, образуют качественно различные тела – «структурные формы вещества», среди этих тел вода, земля, железо, ртуть. При получении химических элементов как «простых тел» пользовались универсальным по тому времени методом разложения «сложных тел» – прокаливанием.
Изучение процессов горения привело к появлению первой, хотя она и оказалась ложной, научной теории в химии – теории флогистона, основатель этой теории Г. Шталь. Наблюдая за процессом плавки металлов, например олова, он заметил, что часть металла теряется в виде окалины («извести», как тогда называли), но при соприкосновении с древесным углем вновь превращается в олово. Шталь сделал вывод о том, что уголь участвует в реакции, и предположил, что в угле содержится вещество, которое превращает «известь» в металл. Позже это вещество было названо флогистоном. При всех огромных недостатках теории флогистона (путаница в понятии простого и сложного вещества), впервые были разработаны научные представления о реакциях окисления-восстановления.
Основатель научной химии М.В. Ломоносов в 1756 г. сформулировал один из основополагающих, действующих и по сей день законов естествознания – закон сохранения массы материи: масса веществ, вступивших в реакцию равна массе веществ, образовавшихся в результате реакции.«Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего от одного тела отнимется, столько присовокупится к другому; так если где убудет несколько материи, то умножится в другом месте. Сей всеобщий закон простирается и в самые правила движения; ибо тело, движущее своей силой другое тело, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает».
Гипотеза флогистона была опровергнута А. Лавуазьепосле открытия кислорода и установлении его роли в процессах горения и окисления. Так, явление обжига металлов и горение стали рассматривать как процессы соединения элемента с кислородом, а не как процесс разложения «сложного вещества» на элемент и флогистон. Это была настоящая революция в химии. Лавуазье впервые разделил вещества на простые вещества (химические элементы) и химические соединения.
В 1869г. Д.И. Менделеевсистематизировал известных тогда 62 элементов на основании их атомного веса и представил это в виде таблицы, которая и получила название «Периодическая таблица Менделеева». Периодический закон, сформулированный Менделеевым, гласит: «Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел ими образованных, состоят в периодической зависимости от их атомного веса».
Современнаяформулировка периодического закона: свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины положительного заряда ядра их атомов.
В этой таблице ярко выявлена периодичность изменения свойств элементов с увеличением их сложности в каждом новом периоде. Систематизация элементов, выполненная Менделеевым, оказала основополагающее влияние на дальнейшее развитие химических исследований. На основании выявленных общностей он предсказал существование неизвестных элементов, оставив для них вакантные места в периодической таблице. Впоследствии эти элементы были открыты и свойства их оказались такими, какие предсказал Менделеев.
В настоящее время доказано, что атом является сложной делимой субъединицей вещества. Вся масса атома сосредоточена в его ядре (~10–13 см). Ядро атома состоит из протонов (р), несущих положительный заряд (+1) и обладающих массой. Заряд ядра равен порядковому номеру элемента. Вокруг ядра по орбиталям вращаются электроны (е) – частицы с зарядом –1. Количество электронов равно количеству протонов, атом в целом электронейтрален. Ядро атома кроме протонов содержит нейтроны (n) – частицы, не имеющие заряда, но обладающие массой.
Пример строения хлора (С): порядковый номер 17, а атомная масса 37, число электронов 17, ядро содержит 17 протонов и 20 электронов.
Ядра элементов могут содержать различное количество нейтронов, так есть атомы хлора, обладающие атомной массой 37 и 35, их ядра содержат 20 и 18 нейтронов соответственно – это так называемые изотопы(37Сl, 35Сl).
Изотопы – атомы с одинаковым зарядом ядра (и соответственно химическими свойства), но разным числом нейтронов.
Химический элемент – вид атомов с одинаковым зарядом ядра, т. е. это совокупность изотопов.
С начала ХIХ в. активно обсуждался вопрос о том, что относится к химическим соединениям, а что к смесям.
Ж. Пруст сформулировал закон постоянства состава: любое индивидуальное химическое соединение обладает строго определенным неизменным составом, «прочным притяжением составных частей» (атомов) и тем отличается от смесей.
С позиций атомно-молекулярного учения данный закон был обоснован химиком Д. Дальтоном; он, что все простые и сложные индивидуальные вещества состоят из мельчайших частиц – молекул, которые в свою очередь образованы из атомов химических элементов. Так, молекулы простых веществ – водорода (Н2), кислорода (О2), озона (О3), – образованные из атомов одного элемента. Молекулы сложных веществ образованы из разных атомов.
К. Бертолле утверждал возможность существования индивидуальных химических соединений переменного состава с непрерывным изменением. Так, интерметаллические соединения, состоящие из 2 металлов: цинк-сурьма, магний-серебро и др. образуют соединения, как с постоянным, так и с переменным составом. Н.С. Курнаков первые из них назвал дальтонидами в честь Ж. Дальтона, а вторые – бертоллидами в честь К. Бертолле.
Молекула – наименьшая частица вещества, обладающая его химическими свойства и состоящая их одинаковых или разных атомов. В состав молекул входят атомы. Большинство неорганических веществ не имеют молекулярного строения.
Атом – наименьшая частица химического элемента, носитель его свойств.
Химическое соединение – определенное вещество, состоящее из одного или нескольких химических элементов, атомы которых химической связью объединены в частицы – молекулы, комплексы, монокристаллы или иные агрегаты.
Развитие учения о структуре молекул. При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию многоатомной системы – молекулы, молекулярного иона или кристалла.
Химическая связь – взаимодействие атомов, обусловленное перекрытием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Й. Берцелиусв 1830 г. выдвинул гипотезу: все атомы разных элементов обладают различной электроотрицательностью, причем атом каждого элемента несет два заряда (положительный + и отрицательный –). Объединение атомов в молекулы происходит за счет взаимодействия разноименно заряженных атомов или атомных групп, что сопровождается частичной нейтрализацией зарядов. Например, калий (К) несет положительный заряд, а кислород (О) – отрицательный, взаимодействуя, они образуют оксид. Однако, теория Берцеллиуса, основанная на электростатическом взаимодействии зарядов, не могла объяснить образование молекул из двух одинаково заряженных атомов, например, молекулы О2.
В 1916 г. Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам – эта идея послужила основой для разработки современной теории ковалентной связи. В том же году В. Коссель предположил, что химическая связь возникает при взаимодействии двух атомов, один из них отдает электроны, превращаясь в положительно заряженный ион (катион), а второй атом принимает электрон, превращаясь в отрицательно заряженный ион (анион). Дальнейшее развитие идей Косселя привело к созданию представлений об ионной связи.
Ковалентная связь – химическая связь между атомами, осуществляемая обобществляемыми электронами. Ковалентная связь между одинаковыми атомами называется неполярной (Н· + ·Н® Н: Н или Н – Н). Ковалентная связь возникающая при взаимодействии атомов разных элементов называется полярной, при этом общая электронная пара (или электронные пары) несколько смещаются в сторону более полярного атома (H – Cl, С≡O).
Ионная связь – химическая связь, осуществляемая за счет электростатического притяжения образовавшихся разноименных ионов (Na+ Cl–, NH4+ OH–).
Металлическая связь – многоцентровая химическая связь с дефицитом электронов в твердом или жидком состоянии, основанная на обобществлении внешних электронных атомов. Металлическая связь характерна только для конденсированного состояния вещества в жидкости или твердом веществе.
Электрически нейтральные атомы и молекулы способны к дополнительному взаимодействию друг с другом: водородная связь – химическая связь, осуществляемая между положительно поляризованным атомом водорода и отрицательно поляризованным атомом F, O и N (реже Cl, S и др.), принадлежащих другой или той же молекуле (НF … HF, Н2О … Н2О).
Ф. Кекулесформулировал теорию валентности – каждый атом обладает определенной способностью к насыщению, т.е. валентностью, или числом единиц сродства. Благодаря этому появилась возможность составлять так называемые структурные формулы. При написании в любой формуле элементы связывают друг с другом согласно их валентности.
Позже А.М. Бутлеров разработал теорию строения органических соединений:
1. Атомы в молекулах соединены химическими связями согласно их валентности в определенном порядке.
2. Атомы и группы атомов, соединенные в молекуле, оказывают взаимное влияние.
3. Химическое строение вещества определяет его свойства.
4. Изучая химические превращения вещества, можно установить строение вещества и выразить его одной единственной структурной формулой.
Теория Бутлерова явилась фундаментом для развития органической химии.
Развитие учения о химических процессах. Химические реакции – взаимодействие между атомами и молекулами, приводящее к образованию новых веществ, отличных от исходных по химическому составу или строению. Химические реакции в отличие от ядерных не изменяют ни общего числа атомов в системе, ни изотопного состава элементов. Методы управления химической реакцией можно разделить на термодинамические и кинетические, среди последних ведущую роль выполняют каталитические процессы.
Химическая термодинамика отвечает на вопросы о принципиальной возможности протекания данной химической реакции в определенных условиях и о конечном равновесном состоянии системы.
Система – совокупность тел, выделенная из пространства. Если в системе возможен массо- и теплообмен между всеми ее составными частями, то такая система называется термодинамической. Химическая система, в которой возможно протекание реакций, представляет собой частный случай термодинамической. Если между системой и окружающей средой отсутствует массо- и теплообмен, то такая система называется изолированной. Если отсутствует массообмен, но возможен теплообмен, то система называется закрытой. Если же между системой и окружающей средой возможен и массо-, и теплообмен, то система открытая. Система, состоящая из нескольких фаз, называется гетерогенной, однофазная система – гомогенной.
Состояние химической системы определяется свойствами: температура, давление, концентрация, объем, энергия.
Реакции, протекающие в гомогенной системе, развиваются во всем ее объеме и называются гомогенными. Реакции, происходящие на границе раздела фаз – гетерогенными.
Для термодинамического описания системы пользуются так называемыми функциями состояния системы – это любая физическая величина, значения которой однозначно определяются термодинамическими свойствами системы. К важнейшим функциям состояния системы относятся: полная энергия системы (Е); внутренняя энергия системы (U); энтальпия (или теплосодержание) – это мера энергии, накапливаемая веществом при его образовании (Н): Н = U + р∙V; энтропия – мера неупорядоченности системы (S); энергия Гиббса – мера устойчивости системы при постоянном давлении (G): ∆G = ∆H – T∙∆S; энергия Гельмгольца – мера устойчивости системы при постоянном объеме (F): ∆F = ∆U – T∙∆S.
Судить о возможности самопроизвольного протекания процесса можно по знаку изменения функции свободной энергии Гиббса: если ∆G < 0, т.е. в процессе взаимодействия происходит уменьшение свободной энергии, то процесс термодинамически возможен. Если ∆G > 0, то протекание процесса невозможно. Таким образом, все процессы могут самопроизвольно протекать в сторону уменьшения свободной энергии.
Химическое взаимодействие, как правило, сопровождается тепловым эффектом. Процессы, протекающие с выделением теплоты, называются экзотермическими (∆ Н < 0), а идущие с поглощением теплоты – эндотермическими (∆ Н > 0).
Тепловой эффект химических процессов в изобарных условиях определяется изменением энтальпии, т.е. разницей энтальпий конечного и исходного состояний. Согласно, закону Лавуазье-Лапласа: теплота, выделяющаяся при образовании вещества, равна теплоте, поглощаемой при разложении такого же его количества на исходные составные части.
Более глубокие обобщения термохимических закономерностей дает закон Гесса: тепловой эффект химических реакций, протекающих или при постоянном давлении, или при постоянном объеме, не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состояниями системы.
I закон термодинамики (закон сохранения энергии) – энергия не исчезает и не возникает вновь из ничего при протекании процесса, она лишь может переходить из одной формы в другую в строго эквивалентных отношениях.
II закон термодинамики – при протекании процесса в изолированной системе обратимых процессов энтропия остается неизменной, а при необратимых процессах увеличивается.
Реакционная способность веществ. Химическая кинетика – раздел химии, изучающий закономерности протекания физико-химических процессов во времени и механизмы взаимодействия на атомно-молекулярном уровне. Химическая кинетика рассматривает зависимость скорости химической реакции от концентрации реагентов, температуры, свойств среды, электромагнитного излучения и других факторов. Скорость химической реакции (v) – изменение концентрации (С) реагирующих веществ или продуктов реакции в единицу времени (τ) в единице объема системы (для гомогенной реакции) или на единицу площади поверхности раздела фаз (для гетерогенной реакции). v = ∆С / ∆τ.
Зависимость скорости химических реакций от концентраций реагирующих веществлегко понять исходя из молекулярно-кинетических представлений. Молекулы газов, двигаясь в различных направлениях с довольно большой скоростью, неизбежно должны встречаться, сталкиваться друг с другом. Взаимодействие между молекулами, очевидно, может происходить только при их столкновениях, следовательно, чем чаще будут сталкиваться молекулы, тем быстрее будет идти превращение исходных веществ в новые и тем больше будет скорость реакции.
К. Гульдберг и П. Ваагев 1867 г. сформулировали закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ.
Скорость гомогенной химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени. Так, для гомогенной реакции типа А + 2В → АВ2 закон действующих масс выражается следующим образом: v = k∙[A]∙[В]2 где [A] и [В] – концентрации вступающих в реакции веществ, k – константа скорости реакции, зависящая от природы реагирующих веществ.
При гетерогенных реакциях концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действующих масс.
Скорость всякой реакции непрерывно уменьшается с течение времени, так как взаимодействующие вещества постепенно расходуются и концентрации их уменьшаются. Поэтому, говоря о скорости реакции, всегда имеют в виду скорость в данный момент, т.е. то количество вещества, которое подверглось бы превращению, если бы существующие в данный момент концентрации поддерживались искусственно в течение определенного промежутка времени.
Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на 10°С скорость большинства реакций возрастает в 2–4 раза.
Отношение константы скорости при температуре t + 10° к константе при температуре t называется температурным коэффициентом скорости (γ).
В общем случае, если температура изменилась на ∆ t °, уравнение зависимости скорости реакции от температуры имеет вид: vt+∆t / vt = γ∆t/10
Так, если температурный коэффициент скорости реакции равен 3, то, во сколько возрастет скорость реакции при повышении температуры от 20 до 60 °С? Поскольку ∆ t = 60 – 20 = 40 °С, то, обозначив соответственно скорость реакции при 20 и 60 °С соответственно через v и v´, можем записать изменения скорости реакции: v´ / v = 340/10 = 34 = 81 раз. Сильное возрастание скорости реакции при повышении температуры связано с резким возрастанием числа активных частиц и числа активных столкновений.
Зависимость скорости химической реакции от присутствия катализаторов и ингибиторов – веществ, которые изменяют скорость реакции, но сами в результате реакции остается в химически неизменном состоянии и не расходуется. Вещества, ускоряющие реакцию, называются катализаторами, а замедляющие – ингибиторами. Иногда применение катализаторов может увеличить скорость реакции в 1000 и более раз.
Катализ – изменение скорости химической реакции в присутствии катализаторов.Скорость химической реакции возрастает в присутствии катализатора, в связи с понижением энергия активации реакции через образование нестойких промежуточных соединений – активных комплексов. Процесс, идущий с образованием активного комплекса кинетически более выгоден, т.к. требуется меньшей затраты энергии.
Нередко один из продуктов реакции служит катализатором, ускоряющим эту реакцию. Такого рода реакции, называются автокаталитическими. Например, кислота, образующаяся при гидролизе эфиров, катализирует этот гидролиз. Скорость автокаталитических реакций в течение некоторого времени (период индукции) мала, но по мере накопления продукта – катализатора, растет, достигает максимума и снова уменьшается вследствие расхода исходного вещества. В таких реакциях возможно протекание явлений самоорганизации, приводящее к образованию пространственных и пространственно-временных диссипативных структур.
Ярким примером автокаталитического процесса является гомогенная периодическая химическая реакция окисления лимонной кислоты смесью бромата калия КВrО3 и сульфата церия Се(SО4)2, открытая и исследованная русскими химиками Белоусовым и Жиботинским в 1951 г. Смесь этих веществ, растворенная в разбавленной серной кислоте, дает реакцию восстановления церия: Се4+(синего цвета)→Се3+(красного цвета), а затем, когда свободный ион брома расходуется (выступает как ингибитор окисления церия), протекает обратная реакция окисления: Се3+→ Се4+. В результате возникает система, которая с идеальной периодичностью изменяет свой цвет с синего на красный и наоборот. Эти колебания можно рассматривать как химические часы, а саму систему как самоорганизующуюся. Начиная с некоторого момента числа колебаний системы, спонтанно возникают неоднородности концентрации и образуются устойчивые красные и синие слои.
Химическое равновесие. Принцип Ле Шателье. Многие химические реакции протекают таким образом, что исходные вещества целиком превращаются в продукты реакции или, как говорят, реакция идет до конца. Так, например, бертолетова соль при нагревании вся без остатка превращается в хлористый калий и кислород: 2КСlО3 = 2КСl + 3О2.Обратное получение бертолетовой соли из хлористого калия и кислорода оказывается невозможным. Такого рода реакции называются практически необратимыми, или односторонними.
Процессы, которые при одних и тех же условиях могут идти как в ту, так и в другую сторону, называются обратимыми, или двусторонними.
Чтобы показать, что химический процесс обратим, в уравнении реакции заменяют знак равенства двумя стрелками, направленными в противоположные стороны:
Fe3O4 + 4Н2  3Fe + 4Н2О
3Fe + 4Н2О
Реакцию, протекающую в направлении слева направо, принято называть прямой, противоположную реакцию – обратной.
Характерная особенность обратимых реакций заключается им, что они не доходят до конца, если продукты реакции не удаляются из сферы взаимодействия (например, при реакциях между газами в закрытом сосуде). Исходные вещества, если даже они были и взяты в эквивалентных количествах, никогда не расходуются полностью на образование продуктов реакции. Реакция идет лишь до известного предела и затем как бы останавливается.
Если реакция обратима, т.е. она может протекать как в прямом, так и обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, когда скорости прямой и обратной реакции становятся одинаковыми, наступает состояние химического равновесия. N2(г) + 3H2(г)  2NH3(г)
2NH3(г)
Установившееся между данными веществами химическое равновесие может сохраняться при неизменных условиях как угодно долго, но при изменении условий протекания реакции (температуры, давления, концентрации участвующих в реакции веществ), скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. Направление этого смещения подчиняется принципу Ле Шателье: при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению этого воздействия.
Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т. е. охлаждением системы; повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведет к смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных веществ приводит к сдвигу равновесия в направлении обратной реакции.
Развитие представлений об эволюционной химии. Эволюционная химия рассматривает вопросы эволюционного развития и совершенствования химической формы материи, в том числе в процессах ее самоорганизации до перехода в биологическую форму.
Из известных в настоящее время 112 химических элементов большинство принимают участие в жизнедеятельности живых организмов. Однако основу живых систем составляют только 4 элемент (98%) – углерод, водород, кислород, азот– макроэлементы. К микроэлементам относятся магний, натрий, калий, кальций, железо, калий, сера, фосфор, хлор; в сумме они составляют около 2-3%. К группе ультрамикроэлементов относят цинк, медь, йод, фтор, марганец, кобальт, кремний и др. (суммарное содержание порядка 0,1%). Из известных сегодня более 20 млн. химических соединений, основная доля приходится на долю органических вещества.
Химическая эволюция среди огромного количества соединений для построения живых организмов отобрала лишь несколько сотен. Так, в состав белков входит только 20 аминокислот, всего четыре нуклеотида участвуют в построении ДНК и РНК, ответственных за наследственность и регуляцию белкового синтеза в любых живых организмах. В ходе эволюции отбирались те структуры, которые способствовали резкому повышению активности и селективности действия каталитических групп.
В основе химических процессов клетки лежит биокатализ, основанный на способности различных природных веществ, участвующих в химических реакциях, управлять ими, замедляя или ускоряя их протекание. Ферменты (энзимы) – белки, обладающих каталитической активностью.
В 1964 г. проф. А.П. Руденко представил теорию самоорганизации элементарных открытых каталитических систем, в последствии ставшая основой общей теории химической эволюции и биогенеза, раскрывающая многие важные эволюционные вопросы. Химическая эволюция представляет собой саморазвитие каталитических систем. Теория саморазвития открытых каталитических систем дает возможность определить рубеж перехода неживого в живое.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 659; Нарушение авторских прав?; Мы поможем в написании вашей работы!