
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость газов в воде
|
|
|
|
Растворимость углеводородных газов в воде по сравнению с их растворимостью в углеводородных жидкостях весьма мала, но, учитывая большие площади контакта воды с газом, например, в газовых залежах или в искусственных газохранилищах, необходимо исследовать процессы растворения газов в воде, особенно при больших давлениях.
Процессы растворения в воде для газов рассматривают, как правило, относительно его отдельных компонентов в виде объема газового компонента растворенного в единице объема воды:
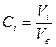 ;
;
или в единице массы воды:
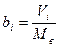 ;
;
или в виде молярных долей:
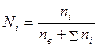 .
.
В приведенных формулах 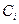 - концентрация i - го компонента газа, растворенного в воде;
- концентрация i - го компонента газа, растворенного в воде; 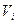 - объем газового компонента, приведенного к нормальным условиям;
- объем газового компонента, приведенного к нормальным условиям; 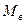 - масса воды, в которой растворен компонент;
- масса воды, в которой растворен компонент; 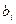 - удельная концентрация i - го компонента газа, растворенного в единице массы воды;
- удельная концентрация i - го компонента газа, растворенного в единице массы воды; 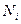 - молярная концентрация i - го компонента газа, растворенного в воде;
- молярная концентрация i - го компонента газа, растворенного в воде; 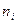 - число молей i - го компонента в газе;
- число молей i - го компонента в газе; 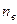 - число молей воды.
- число молей воды.
Растворимость газов в воде зависит от степени минерализации воды и температуры (рис.2.2.14): В соленой воде газ растворяется хуже, чем в дистиллированной, что по аналогии с процессом растворения сахара в воде можно объяснить тем, что в дистиллированной воде свободного пространства внутри молекул воды, которое может быть занято молекулами газа, больше, чем в соленой.
Более сложный характер имеет процесс растворения газа в воде с изменением температуры – растворимость газов вначале уменьшается до некоторого минимума, а затем растет (рис.2.2.15). Температура минимальной растворимости зависит от давления (с повышением давления увеличивается) и от размеров молекул газа (чем больше размер молекул, тем выше минимальная температура растворимости).
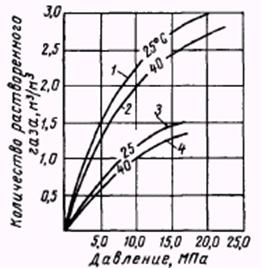
Рис.2.2.14. Кривые растворимости газа в дистиллированной (1,2) и соленой (раствор NaCl) воде (3,4) при различных температурах.
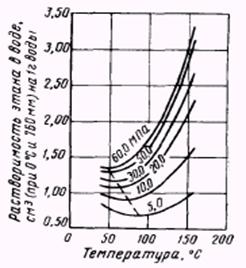
Рис.2.2.15. Зависимость растворимости этана от температуры при различных давлениях.
Для выражения растворимости данного компонента газа в воде используется константа равновесия:
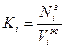 ,
,
где 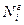 и
и 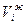 - молярные доли компонента в газовой и жидкой фазах.
- молярные доли компонента в газовой и жидкой фазах.
Влияние на растворимость газа содержащейся в воде соли учитывается уравнением Сеченова:
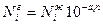 ,
,
где 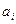 - коэффициент Сеченова, характеризующий влияние данной соли на растворимость i – го компонента газа; n – концентрация соли в воде.
- коэффициент Сеченова, характеризующий влияние данной соли на растворимость i – го компонента газа; n – концентрация соли в воде.
Вопросы для закрепления:
- Сформулируйте закон Генри растворимости газа в жидкости.
- Что такое коэффициент разгазирования?
- Почему приращение объема жидкости не соответствует истинному объему растворенного в ней газа?
- Какое давление называется давлением насыщения нефти газом?
- Что характеризует коэффициент сжимаемости?
- Как определяется объемный коэффициент?
- Что такое усадка нефти?
- Как изменяются плотность и вязкость нефти в пластовых условиях?
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1761; Нарушение авторских прав?; Мы поможем в написании вашей работы!