
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение состава двух- и более компонентных систем
|
|
|
|
Еще одним способом изображения состояния двухкомпонентных систем является РС – диаграмма (С – состав смеси). На такой диаграмме (рис.2.3.8) можно не только отражать фазовое состояние двухкомпонентной системы (т.е. узнать находится оно в одно- или двухфазном состоянии), но и определить, сколько весовых или молярных долей данного вещества приходится на жидкую и газовую фазы и каков состав фаз в количественном соотношении.

Рис.2.3.8. Фазовая диаграмма двухкомпонентной смеси в координатах «давление – состав» при постоянной температуре.
I – жидкость; II – газ; III – двухфазное состояние.
Нижняя кривая на РС - диаграмме является кривой точек росы, верхняя – кривой точек кипения. Область, ограниченная этими кривыми, соответствует двухфазному состоянию системы. Используя такие диаграммы-изотермы, можно не только определить в каком состоянии находится система, но и вычислить, сколько весовых или молярных долей смеси находится в жидкой и газовой фазах, а также баланс фаз для каждого компонента. Ниже приводится схема такого расчета.
Пусть известно весовое или молярное содержание одного из компонентов смеси: на РС – диаграмме, приведенной на рис.2.3.6, это отмечено молярной долей z более летучего компонента (именно его концентрация откладывается, как правило, по оси абсцисс), соответствующего точке В. В точке С этот компонент будет находиться в газовой фазе с мольной долей, в точке А этот же компонент находится в жидком состоянии с мольной долей x. Если суммарное количество молей системы равно n, причем из них nl в жидкой фазе и ng – в газовой, то очевидно:
n = nl + ng,
а для более летучего компонента:
n z = nl x+ ng,y.
Из этих двух соотношений получим:
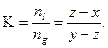
Таким образом, зная давление и состав (общее число молей и концентрацию), можно определить соотношение молей системы, находящихся в жидкой и газовой фазах, а, следовательно, константу фазового равновесия в двухкомпонентной смеси.
В случае трех- и более компонентных систем строят треугольные фазовые диаграммы. И если компонентов больше трех, их условно разбивают на три группы: сухой газ (как правило, метан), бензиновая фракция (С2 – С6) и тяжелый остаток (С7+высшие).
На рис.2.3.9. представлена одна из таких диаграмм. Предполагается, что система состоит из трех компонентов А1, А2, А3. Вершина треугольника соответствуют 100%-му содержанию соответствующего компонента, противоположная сторона – полному его отсутствию в системе: в точке А1 (А1=1,А2=А3=0), в точке А2 (А2=1,А1=А3=0), в точке А3 (А3=1,А1=А2=0); на линии А2А3 (А1=0), на линии А2А1 (А3=0), на линии А1А3 (А2=0).
Рассмотрим диаграмму. Пусть состав системы характеризуется точкой В (газообразное состояние). Концентрация компонентов в этой точке будет равна: А1=x, А2=y, А3=z.

Рис.2.3.9. РС фазовая диаграмма для трехкомпонентной системы.
Область, ограниченная кривыми 1 и 2, соответствует двухфазному состоянию при давлении Р2 >Р1. Пусть теперь состав трехкомпонентной смеси характеризуется точкой В0, находящейся в двухфазной области, а концентрация распределится так: А1=x0, А2=y0, А3=z0.
Можно доказать, что 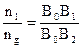
(точка В1 – характеризует состав газовой фазы, точка В2 - жидкой).
Величина  называемая константой фазового равновесия, определяется экспериментально и расчетным путем.
называемая константой фазового равновесия, определяется экспериментально и расчетным путем.
Значение k особенно важно для газоконденсатных залежей, состояние которых постоянно меняется, в т.ч. в зависимости от режима работы скважины.
Вопросы для закрепления:
- Сформулируйте правило фаз Гиббса.
- Что называется упругостью пара?
- В чем отличие уравнения Ван –дер-Ваальса и экспериментальной диаграммой фазового состояния для однокомпонентной смеси?
- В чем состоит сходство и различие фазовых диаграмм для однокомпонентной и бинарной смесей?
- Какая точка на фазовой диаграмме называется критической?
- Дайте определения терминам крикондентерм и криконденбар.
- Выведите формулу для константы фазового равновесия в однокомпонентной смеси.
- Запишите и поясните уравнение Клаузиуса-Клапейрона.
- Что такое газовый гидрат?
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 886; Нарушение авторских прав?; Мы поможем в написании вашей работы!