
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства пептидной связи
|
|
|
|
Четвертичная структура
Третичная структура
Разные способы изображения трёхмерной структуры белка на примере триозофосфатизомеразы. Слева – «стержневая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине –мотив укладки. Справа – контактная поверхность белка, построенная с учётом ван-дер-ваальсовых радиусов атомов; цветами показаны особенности активности участков
Третичная структура – пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
– ковалентные связи (между двумя остатками цистеина – дисульфидные мостики);
– ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
– водородные связи;
– гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура (или субъединичная, доменная) – взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
https://ru.wikipedia.org/wiki/Белки
Пептидная связь – основные параметры и особенности
Пептидная связь – вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (– NH2) одной аминокислоты с α-карбоксильной группой (– СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
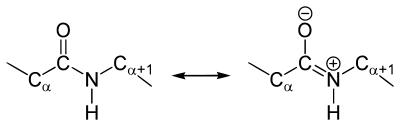
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
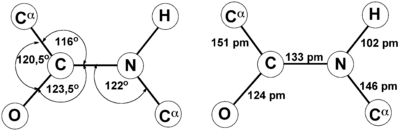
Это обусловливает следующие свойства:
– 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
– H и O в пептидной связи, а также α-углероды двух аминокислот транс-ориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также транс-ориентированы.
– Вращение вокруг связи C-N затруднено, возможно вращение вокруг С-С связи.
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
https://ru.wikipedia.org/wiki/Пептидная связь
Литература:
1) Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. В 3 томах. – М.: Мир, 1994.
2) Ленинджер А. Основы биохимии. В 3 томах. – М.: Мир, 1985.
3) Страйер Л. Биохимия. В 3 томах. – М.: Мир, 1984.
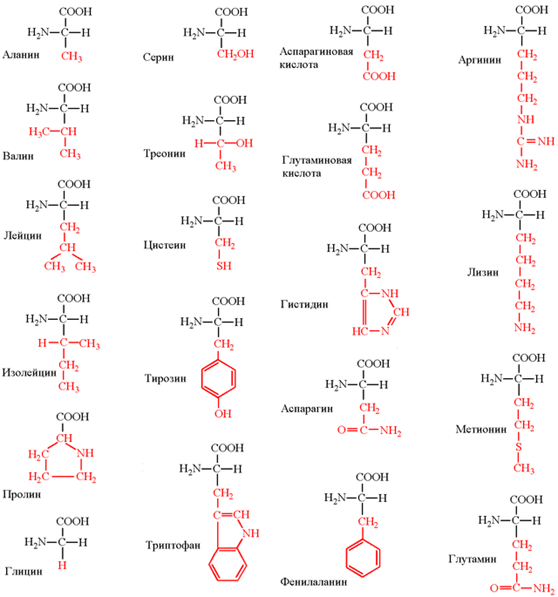
1.3. Аминокислоты - структурные мономеры белков. Строение, номенклатура, классификация и свойства аминокислот.
Аминокисло́ты (аминокарбо́новые кисло́ты) – органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 9812; Нарушение авторских прав?; Мы поможем в написании вашей работы!