
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартные электродные потенциалы
|
|
|
|
Мерой склонности веществ к окислению и восстановлению служит стандартный электродный потенциал.
Если погрузить пластинку некоторого металла в водный раствор его собственной соли (Сu в раствор СuSО4 или Zn в раствор ZnSО4), то в та-кой системе возможно протекание двух противоположных электрохимических процессов:
1) катионы могут восстанавливаться и осаждаться в виде атомов из раствора соли на металл (так как для разряда этих ионов расходуются электроны, то в самом атоме металла возникает недостаток электронов): Mn+ + ne = M0
2) атомы металла могут окисляться и переходить в раствор (выделяющиеся электроны остаются в металле и обусловливают их избыток): M0 – ne = Mn+
Склонность катионов к восстановлению обычно возрастает с повышением концентрации соли в растворе.
Склонность металлов к окислению зависит от химической природы металла. Так, для цинка она значительно выше, чем для меди. Если предположить, что концентрации веществ в растворе одинаковы, то цинк поставит в раствор большее число катионов, чем медь, а следовательно, на цирковой пластинке останется больше электронов.
Благодаря электростатическому притяжению между катионами и электронами катионы удерживаются вблизи поверхности металла. В результате возникает двойной электрический слой (рис. 1) и появляется разность электрических потенциалов.
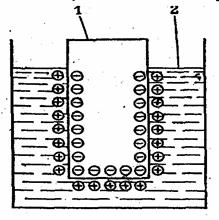
Рис. 1. Двойной электрический слой на границе раздела металл – раствор его соли. 1 -- металлическая пластина; 2 – раствор.
Подобная система — металл, погруженный в раствор электролита, называется электродом.
Электроды — это система из двух токопроводящих тел: проводников 1-го и 2-го рода.
К проводникам 1-го рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам 2-го рода относятся расплавы и растворы электролитов, носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом. Абсолютное значение разности потенциалов, возникающее на границе металл – электролит принципиально измерить нельзя никакими средствами, так как она возникает между двумя фазами разной природы (твердый металл — жидкий раствор). Однако можно измерить разность потенциалов двух химически различных электродов, приняв один из них за электрод сравнения.
В качестве электрода сравнения обычно используют электрод Н+/Н2(Г) — водородный электрод, предложенный немецким физико-химиком Нернстом.
Этот электрод состоит, из платиновой пластины, покрытой платиновой чернью которая погружена в раствор, содержащий катионы водорода, обычно раствор НСl или Н2SО4. Через раствор непрерывно пропускают газообразный водород под постоянным давлением.
Чтобы можно было сравнивать значения разности потенциалов различных электродов, следует работать в стандартных условиях. В качестве таковых приняты: тёмпература 25°С (298,15 К), давление 101,325 кПа (1 атм), концентрация ионов 1 моль/л (при точных расчетах вместо аналитической концентрации используют активность электролитов. В электроде сравнения, называемом стандартным водородным электродом, поддерживается концентрация катионов водорода 1 моль/л и давление газообразного водорода, равное 101,3 кПа (1 атм).
Разность потенциалов стандартного водородного электрода и какого-либо другого электрода (металл/раствор соли металла), измеренная при стандартных условиях, называется стандартным электродным потенциалом (обозначение Е°).
Стандартный потенциал стандартного водородного электрода условно принят равным нулю. Стандартный водородный электрод трудно реализовать на практике достаточно трудно (требуется чистый водород с постоянной скоростью его подачи). Чаще вместо него используют другие электроды сравнения, например каломельный электрод.
Стандартные потенциалы Е° распространенных металлов Мn+/М0 – табличные данные.
В зависимости от того, положительно или отрицательно заряженным оказывается металлический электрод относительно стандартного водородного электрода, стандартный потенциал пары Мn+/М0 также будет иметь положительное или отрицательное значение.
Например: для цинководородного гальванического элемента, состоящего из цинкового Zn2+/Zn0 и водородного Н+/Н2 электродов, в стандартных условиях разность потенциалов составляет E0 (Zn)= - 0,763В.
Для медноводородного гальванического элемента, состоящего из медного Сu2+/Сu° и водородного Н+/Н2 электродов, в стандартных условиях равность потенциалов составляет E0 (Сu)= +0,338.
Электродные процессы являются особым видом окислительно-восстановительных реакций, которые отличаются тем, что полуреакции окисления и восстановления протекают не в одном растворе, а пространственно разобщены.
|
|
|
|
|
Дата добавления: 2014-12-17; Просмотров: 976; Нарушение авторских прав?; Мы поможем в написании вашей работы!