
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение электродного потенциала
|
|
|
|
Напряжение гальванического элемента тем выше, чем больше отличаются между собой значения стандартного потенциала электродов.
Положительным полюсом гальванического элемента является более благородный металл, на котором имеется недостаток электронов.
Отрицательным полюсом гальванического элемента является менее благородный металл на котором имеется избыток электронов.
Электроны по внешнему участку цепи (по металлическому проводнику) переходят от отрицательного к положительному полюсу гальванического элемента.
При условии примерно равных концентраций электронов в растворах, в которые погружены электроды гальванического элемента, металл с меньшим значением стандартного потенциала будет отрицательным полюсом, а металл с большим значением стандартного потенциала — положительным полюсом.
Например: В гальваническом элементе с цинковым и свинцовым электродами отрицательным полюсом будет цинк (Е° = -0,763В), а положительным полюсом — свинец
(Е° = -0,126 В). Стандартный потенциал свинца более положителен, чем цинка.
Напряжение, которое показывает вольтметр, подключенный к полюсам (клеммам) гальванического элемента, называется напряжением на клеммах. Это напряжение вследствие наличия внутреннего сопротивления источника напряжения меньше действительного напряжения, называемого электродвижущей силой, сокращенно эдс (обозначение (U). Электродвижущая сила гальванического элемента может быть рассчитана, исходя из значений стандартных потенциалов обеих пар, но может быть и экспериментально определена с помощью компенсационной измерительной схемы или посредством вольтметра с бесконечно большим входным сопротивлением.
При стандартных условиях (25°С, 101,3 кПа, концентрация каждого электролита 1 моль/л) действительное напряжение гальванического элемента равно разности между стандартным, потенциалом положительного полюса и стандартным потенциалом отрицательного полюса, т.е.:
U = Е° (+) - Е° (-)
Таким образом, значение U равно разности стандартных потенциалов более благородного металла и менее благородного металла.
По мере прохождения электрического тока через замкнутый гальванический элемент электрод из менее благородного металла разрушается, металл постепенно переходит в раствор в форме ионов. По этой причине гальванические элементы имеют весьма ограниченный срок службы.
При стандартных условиях электродные потенциалы имеют определенные стандартные значения. Для условий, отличных от стандартных (иная концентрация электролита и иная температура) электродные потенциалы будут иметь другие значения. Их можно рассчитать, исходя из стандартных потенцвалов Е° поуравнению электродного потенциала, или урав-нению Нернста:
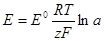
где R — универсальная газовая постоянная, равная 8,3144 Дж/(мольК); Т — термодинамическая температура, К; z — заряд иона; F — постоянная Фарадея, равная 9,6485*104 Кл/моль; а — активность ионов в растворе, моль/л.
При подстановке числовых значений универсальной газовой постоянной и постоянной Фарадея и при переходе к десятичным логарифмам уравнение электродного потенциала принимает вид: Е = Е° + 1,984 •10-4 Т lg a
Для расчета потенциала электрода в растворе электролита при комнатной температуре (18 — 22 °С) можно использовать уравнение Нернста в следующей форме:

Например: Потенциал медного электрода (z = 2) в растворе с активностью а = 0,001 моль/л равен:
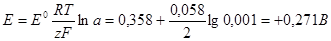
При активности электролита в растворе (практически равной для разбавленных растворов молярной концентрации), меньшей 1 моль/л, электродный потенциал уменьшается при прочих равных условиях.
Поскольку электродный потенциал зависит от концентрации электролита, то можно получить гальванический элемент, совмещая химически одинаковые электроды, отличающиеся только концентрацией электролита. Такие гальванические элементы называются концентрационными. В общем виде концентрационный элемент можно описать формулой:
(+) Металл | Электролит (а1) ||Электролит (а2)|Металл (-)
|
|
|
|
|
Дата добавления: 2014-12-17; Просмотров: 594; Нарушение авторских прав?; Мы поможем в написании вашей работы!