
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы управляемых каналов
|
|
|
|
.
.
Примем в формуле Нернста Свн/Снар≈100, что по порядку величины соответствуют экспериментальным данным для калия:
lg 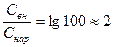 , и мембранный потенциал
, и мембранный потенциал
 = 0,06∙2В = 0,12В = 120мВ,
= 0,06∙2В = 0,12В = 120мВ,
что несколько больше модуля экспериментально измеренных значений потенциала покоя, и, пользуясь формулами электростатики, оценим, какое количество ионов должно перейти из цитоплазмы в неклеточную среду, чтобы создать такую разность потенциалов. Радиус клетки r = 10 мкм = 10-5 м. Удельная электроемкость мембраны (электроемкость на единицу площади) Суд=10-2 Ф/м2. Площадь мембраны 4πr2 ≈ 4π∙10-10м2 ≈10-9м2. Тогда электроемкость мембраны
C=Cуд∙S≈10-2 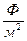 ∙10-9 м2.
∙10-9 м2.
Абсолютная величина заряда каждого знака на поверхности мембраны, если ее представить себе как конденсатор,
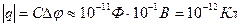 ,
,
что соответствует

Объем клетки
V= 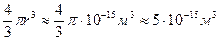 .
.
Изменение концентрации ионов в клетке вследствие выхода из клетки 10-17 моль ионов составит 
∆С≈ 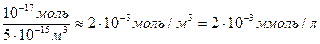 .
.
Это ничтожное изменение концентрации по сравнению с изменением концентрации ионов калия внутри клетки, составляет всего 10-4% от концентрации калия внутри клетки. Таким образом, чтобы создать равновесный нернстовский мембранный потенциал, через мембрану должно пройти пренебрежимо малое количество ионов по сравнению с общим их количеством в клетке.
Таким образом, потенциал покоя на самом деле ближе к потенциалу, рассчитанному по формуле Нернста для К+.Вместе с тем, обращает на себя внимание значительное расхождение экспериментальных и теоретических значений. Причины расхождения в том, что не учтена проницаемость мембраны для других ионов. Одновременная диффузия через мембрану ионов К+, Na+ и С1- учитывается уравнением Гольдмана.
Уравнение Гольдмана можно вывести из уравнения Нернста-Планка.
 .
.
Преобразуем это уравнение:


URT=D согласно соотношению Эйнштейна. Примем так называемое приближение постоянного поля Гольдмана. Будем считать напряженность электрического поля в мембране постоянной и равной среднему значению градиента потенциала:


где l – толщина мембраны.
Получим для плотности ионного потока через мембрану:
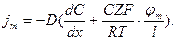
Обозначим  Запишем
Запишем 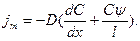
Разделим переменные:

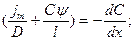

Проинтегрируем левую часть дифференциального уравнения в пределах от 0 до 1, а правую от Снар=КСнар до Свн=КСвн (где К – коэффициент распределения)

Получим:

После потенциирования

Выразим отсюда:

Учитывая, что  , получим:
, получим:

В стационарном случае, когда разность потенциалов - мембранный потенциал - тормозит дальнейший перенос ионов через мембрану, суммарный поток различных ионов становится равным нулю:
jK+ + jNa+ - jCl- = 0
Перед j. стоит знак минус, учитывающий отрицательный заряд иона хлора. Однако, так как в создании мембранного потенциала участвуют различные ионы, равновесие при этом не наступает, потоки различных ионов не равны нулю по отдельности. Если учесть только потоки jK+ и jNa+, то jK++jNa+=0, или jK= - jNa+ и, подставив, получим:

и
 .
.
Отсюда:

Поскольку,
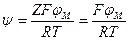 , (Z =1),
, (Z =1),
то
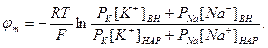
Если учесть еще и поток ионов С1-, то, повторив предыдущие рассуждения, можно получить уравнение для мембранного потенциала, созданного потоками через мембрану трех видов ионов, уравнение Гольдмана:

В числителе выражения, стоящего под знаком логарифма, представлены концентрации [К+]ВН, [Na+]BH, но [С1-]НАР, а в знаменателе - [К+]НАР, [Na+]HАР, но [С1-]ВН, так как ионы хлора отрицательно заряжены.
В состоянии покоя проницаемость мембраны для ионов К+ значительно больше, чем для Na+, и больше, чем для С1-:
PK>>PNa, PK>PNa.
Для аксона кальмара, например,
PK:PNa:PCl=1:0,04:0,45.
Переписав уравнение Гольдмана в виде:
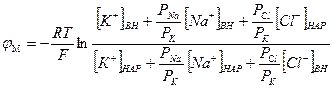 ,
,
в случае, когда проницаемость мембраны для ионов натрия и хлора значительно меньше проницаемости для калия:
PNa << PK, PCl<< PK,
Таким образом, уравнение Нернста - частный случай уравнения Гольдмана.
Мембранный потенциал, рассчитанный по уравнению Гольдмана, оказался по абсолютной величине меньше мембранного потенциала, рассчитанного по формуле Нернста» ближе к экспериментальным его значениям в крупных клетках. И формула Нернста, и уравнение Гольдмана не учитывают активного транспорта ионов через мембрану, наличия в мембранах электрогенных (вызывающих разделение зарядов, а следовательно и возникновение разности потенциалов) ионных насосов, играющих важную роль в поддержании ионного равновесия в мелких клетках. В цитоплазматической мембране работают К+-Nа+-АТФазы, перекачивающие калий внутрь клетки, а натрий из клетки. С учетом работы электрогенных ионных насосов для мембранного потенциала было получено уравнение Томаса:
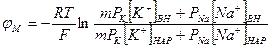 ,
,
где m - отношение количества ионов натрия к количеству ионов калия, перекачиваемых ионными насосами через мембрану. Чаще всего К+-Ка+-АТФаза работает в режиме, когда m = 3/2, m всегда больше 1. (Нет ионных насосов, перекачивающих Сl, поэтому в уравнении Томаса отсутствуют члены Р Сl [ Сl- ].)
Коэффициент m > 1 усиливает вклад градиента концентрации калия в создание мембранного потенциала, поэтому мембранный потенциал, рассчитанный по Томасу, больше по абсолютной величине, чем мембранный потенциал, рассчитанный по Гольману, и дает совпадение с экспериментальными значениями для мелких клеток.
Нарушение биоэнергетических процессов в клетке и работы K+-Na+-АТФазы приводит к уменьшению |φм|, в этом случае мембранный потенциал лучше описывается уравнением Гольдмана.
Повреждение клеточной мембраны приводит к повышению проницаемости клеточных мембран для всех ионов: к повышению и Pк, и PNa, и Pсl Вследствие уменьшение различия проницаемостей абсолютное значение мембранного потенциала |φм| снижается.
Для сильно поврежденных клеток |φм| еще меньше, но сохраняется отрицательный мембранный потенциал |φм| за счет содержащихся в клетке полианионов - отрицательно заряженных белков, нуклеиновых кислот и других крупных молекул, не могущих проникнуть через мембрану (доннановский потенциал).
Потенциал действия
Посредством электрических нервных импульсов (потенциалов действия) в живом организме передается информация от рецепторов к нейронам мозга и от нейронов мозга к мышцам. Живой организм является полностью электрифицированной системой. Без электричества нет жизни.
Потенциал действия был открыт раньше потенциала покоя. Животное электричество известно давно. Разряды электрического угря (происходящие при напряжении до 600 В, с током около 60 А и длительностью порядка миллисекунды) использовались медициной еще в Древнем Риме для лечения подагры, головной боли, эпилепсии. Электрический нервный импульс открыл Луиджи Гальвани, профессор анатомии в г. Болонья. Результаты его электрофизиологических опытов изложены в книге "Трактат о силах электричества при мышечном движении" (1791 г.). Гальвани открыл, что мышечные сокращения конечностей препарированной лягушки могут вызваться электрическим импульсом и что сама живая система является источником электрического импульса. Великое открытие Гальвани сыграло выдающуюся роль в развитии физики, электротехники, электрохимии, физиологии, биофизикии и медицины. Однако, огромная популярность идей Гальвани привела к их профанациям, следы которых остались до нашего времени (гальванизация трупов, гальванизм прикосновений взглядов и т.д.), что вызывало недоверие к экспериментам Гальвани ученых-физиков. Младший современник Гальвани профессор физики Алессандро Вольта был яростым противником идеи животного электричества (за исключением особых случаев электрических рыб: электрического угря и электрического ската). В своих экспериментах он исключил биологический объект и показал, что электрический ток может быть получен при контакте набора металлов, разделенных электролитом (вольтов столб). Так был открыт химический источник тока (названный, однако, позже, в честь его научного противника гальваническим элементом).
В XIX веке утвердилось примитивное представление о распространении электрических токов по нервам, как по проводам. Однако Гельмгольцем (вторая половина XIX века) было показано, что скорость распространения нервного импульса составляет лишь 1-100 м/с, это значительно меньше, чем скорость распространения электрического импульса по проводам до 3 • 108 м/с. Поэтому к концу XIX века гипотеза электрической природы нервного импульса была отвергнута большинством физиологов. Было выдвинуто предположение о распространении по нервным волокнам химической реакции. На самом деле, как было показано позже, медленное распространение электрического нервного импульса связано с медленной перезарядкой конденсаторов, которые представляют собой клеточные мембраны, через большие сопротивления. Постоянная времени перезарядки мембраны τ= RC велика, так как велики емкость мембраны (С) и сопротивление R нервного волокна.
То, что нервный импульс представляет собой импульс электрического тока, было доказано лишь к середине 20-го века, в основном в работах английского физиолога А. Ходжкина и его сотрудников. В1963 году Ходжкину, Хаксли и Иклсу была присуждена Нобелевская премия по медицине "за оперирование нервных клеток".
Потенциалом действия (ПД) называется электрический импульс, обусловленный изменением ионной проницаемости мембраны и связанный с распространением по нервам и мышцам волны возбуждения.
Опыты по исследованию потенциала действия проведены (в основном Ходжкиным и его сотрудниками) на гигантских аксона кальмара методом микроэлектродов с использованием высокоомных измерителей напряжения, а также методом меченых атомов. На риспоказаны схема опытов и результаты исследований.
В опытах по исследованию потенциала действия использовали два микроэлектрода, введенных в аксон. На первый микроэлектрод подается импульс с амплитудой V от генератора Г прямоугольных импульсов, меняющий мембранный потенциал. Мембранный потенциал измеряется при помощи второго микроэлектрода высокоомным регистратором напряжения Р.
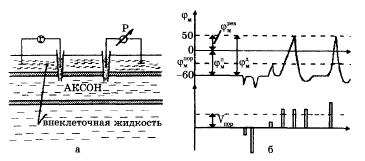
Рис.18. Исследование потенциала действия:
а - схема опыта (Г - генератор импульсов, Р - регистратор напряжения); б - потенциал действия (φпм - потенциал покоя, φревм - потенциал реверсии, φдм - амплитуда потенциала действия, φпорм – пороговый потенциал)
Возбуждающий импульс вызывает лишь на короткое время смещение мембранного потенциала, который быстро пропадает и восстанавливается потенциал покоя. В том случае, когда возбуждающий импульс смещается еще дальше в отрицательную сторону, он сопровождается гиперполяризацией мембраны. Также не формируется потенциал действия, когда возбуждающий импульс положительный (деполяризующий), но его амплитуда меньше порогового значения Vnop. Однако, если амплитуда положительного, деполяризующего импульса окажется больше значения Vnop, φм становится больше φпорм и в мембране развивается процесс, в результате которого происходит резкое повышение мембранного потенциала и мембранный потенциал φм даже меняет свой знак - становится положительным (φвн>φнар).
Достигнув некоторого положительного значения φрев - потенциала реверсии, мембранный потенциал возвращается к значению потенциала покоя φпм, совершив нечто вроде затухающего колебания. В нервных волокнах и скелетных мышцах длительность потенциала действия около 1 мс (а в сердечной мышце около 300 мс. После снятия возбуждения еще в течение 1 -3 мс в мембране наблюдаются некоторые остаточные явления, во время которых мембрана рефрактерна (невозбудима).
Новый деполяризующий потенциал V > Vnop может вызвать образование нового потенциала действия только после полного возвращения мембраны в состояние покоя. Причем амплитуда потенциала действия 
не зависит от амплитуды деполяризующего потенциала (если только V > Vnop). Если в покое мембрана поляризована (потенциал цитоплазмы отрицателен по отношению к внеклеточной среде), то при возбуждении происходит деполяризация мембраны (потенциал внутри клетки положителен) и после снятия возбуждения происходит реполяризация мембраны.
Характерные свойства потенциала действия:
1) наличие порогового значения деполяризующего потенциала;
2) закон "все или ничего", то есть, если деполяризующий потенциал больше порогового, развивается потенциал действия, амплитуда которого не зависит от амплитуды возбуждающего импульса и нет потенциала действия, если амплитуда деполяризующего потенциала меньше пороговой;
3) есть период рефрактерности, невозбудимости мембраны во время развития потенциала действия и остаточных явлений после снятия возбуждения;
4) в момент возбуждения резко уменьшается сопротивление мембраны (у аксона кальмара от 0,1 Ом • м2 в покое до 0,0025 Ом • м2 при возбуждении).
Если обратиться к данным для значений равновесных нернстовских потенциалов, созданных различными ионами, естественно предположить, что положительный потенциал реверсии имеет натриевую природу, поскольку именно диффузия натрия создает положительную разность потенциалов между внутренней и наружной поверхностями мембраны.
Можно менять амплитуду импульса потенциала действия, изменяя концентрацию натрия в наружной среде. При уменьшении наружной концентрации натрия амплитуда потенциала действия уменьшается, так как меняется потенциал реверсии. Если из окружающей клетку среды полностью удалить натрий, потенциал действия вообще не возникает.
Опыты, проведенные с радиоактивным изотопом натрия, позволили установить, что при возбуждении проницаемость для натрия резко возрастает. Если в состоянии покоя соотношение коэффициентов проницаемости мембраны аксона кальмара для разных ионов:
PK: PNa: PCl = 1: 0,04: 0,45
то в состоянии возбуждения:
PK: PNa: PCl = 1: 20: 0,45
то есть, по сравнению с невозбужденным состоянием, при возбуждении коэффициент проницаемости для натрия возрастает в 500 раз.
Расчеты мембранного потенциала реверсии по уравнению Гольдмана, если в него подставить значения проницаемостей мембраны для возбужденного состояния, совпадают с экспериментальными данными.
Возбуждение мембраны описывается уравнениями Ходжкина-Хаксли. Одно из уравнений Ходжкина-Хаксли имеет вид:
 ,
,
где Iм - ток через мембрану, См - емкость мембраны, ∑Ii - сумма ионных токов через мембрану.
Электрический ток через мембрану складывается из ионных токов: ионов калия - Ik+, натрия - INa+ и других ионов, в том числе Сl, так называемого тока утечки Ik, а также емкостного тока. Емкостной ток обусловлен перезарядкой конденсатора, который представляет собой мембрана, перетеканием зарядов с одной ее поверхности на другую. Его величина определяется количеством заряда, перетекающего с одной обкладки на другую за единицу времени dq/dt, а поскольку заряд конденсатоpa q = См∆φ = Смφм, то емкостной ток СМ 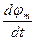 . Полный мембранный ток
. Полный мембранный ток
 .
.
Согласно теории Ходжкина-Хаксли, возбуждение элемента мембраны связано с изменениями проводимости мембраны для ионов Na+ и К+: gK и gNa.
Проводимости мембраны сложным образом зависят от мембранного потенциала и времени.
Будем считать ток, направленный из клетки наружу в окружающий раствор положительным, а внутрь клетки из окружающего раствора - отрицательным.
Обнаружено, что, если поднять мембранный потенциал (φм выше порогового, сначала течет ток внутрь клетки, а затем из клетки наружу).
В экспериментах, проведенных Ходжкиным, Хаксли, Бейкером, Шоу, было доказано, что фаза I мембранного тока связана с потоком ионов натрия из окружающей среды (где концентрация натрия больше) в клетку (где она меньше), а фаза II объясняется вытеканием ионов калия из клетки наружу.
В своих опытах Ходжкин и Хаксли изменяли ионный состав окружающего раствора. Было обнаружено, что, если снаружи убирали натрий, первая фаза мембранного тока (ток внутрь клетки) пропадала. Следовательно, на самом деле, первая фаза развития потенциала действия связана с увеличением проницаемости мембраны для ионов натрия. Поток положительных частиц в клетку приводит к деполяризации мембраны - внутренняя ее поверхность заряжается положительно по отношению к наружной.
Во второй фазе резко увеличивается проницаемость мембраны для калия и из клетки наружу выходят положительно заряженные ионы калия, в то время как натриевый ток уменьшается.
Ионный механизм развития потенциала действия был окончательно доказан в решающем эксперименте Ходжкина, Бейкера и Шоу, в котором аксоплазму препарированного аксона заменили на наружный раствор, а ионный состав наружного раствора сделали таким же, как у нормальной аксоплазмы. При такой замене ионных составов изменила знак разность потенциалов на мембране. Теперь в покое внутренняя ее поверхность была заряжена положительно по отношению к наружной. А потенциал действия оказался отрицательным.
Выдвинута гипотеза, что селективное (избирательное) изменение ионной проницаемости возбужденной мембраны: сначала для Na+, а потом для К+ - объясняется тем, что в мембране имеются специальные ионные каналы. Существуют отдельно натриевые и калиевые каналы, которые открываются и закрываются во время прохождения через данный участок мембраны нервного импульса. В первой фазе - открываются натриевые каналы, во второй фазе - калиевые. Соответственно, сначала закрываются натриевые каналы, а затем калиевые. Открывание и закрывание ионных каналов вызывается изменением мембранного потенциала.
Одно из доказательств наличия в мембране ионных каналов -существование веществ, блокирующих ионные потоки через мембрану.
Так, содержащийся в рыбе фугу тетродотоксин блокирует поступление внутрь клетки натрия и, таким образом, нарушает передачу нервного импульса, что может привести к летальному исходу. Доказано, что тетродотоксин не влияет на проницаемость клетки для калия, значит, ионы натрия и калия на самом деле проходят через разные каналы.
Из-за своего специфического строения молекулы тетродотоксина, по-видимому, застревают в натриевых каналах. Подсчитав число застрявших в мембране молекул тетродотоксина, удалось определить количество натриевых каналов. В разных нервных волокнах позвоночных оно было разным — от 3 до 75 каналов на один квадратный микрометр площади мембраны (для сравнения количество молекул фосфолипидов ≈ 2 • 106 1/мкм2).
Был обнаружен и специфический ингибитор калиевых каналов - тетраэтиламмоний.
Если обработать мембрану тетродотоксином, блокирующим натриевые каналы, в опытах с фиксацией мембранного потенциала пропадает первая фаза, а тетраэтиламмоний прекращающий перенос через мембрану калия, вызывает исчезновение второй фазы.
Таким образом, установлено, что формирование потенциала действия вызывается ионными потоками через мембрану: сначала ионов натрия внутрь клетки, а затем - ионов калия из клетки в наружный раствор, что связано с изменением проводимости мембраны для ионов калия и натрия.
Распространение нервного импульса вдоль возбудимого волокна
Если в каком-нибудь участке возбудимой мембраны сформировался потенциал действия, мембрана деполяризована, возбуждение распространяется на другие участки мембраны. Рассмотрим распространение возбуждения на примере передачи нервного импульса по аксону (рис.).
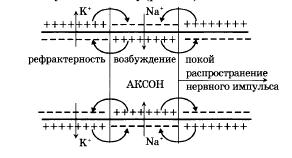
Рис. 19. Локальные токи при распространении нервного импульса по нервному волокну
И в аксоплазме, и в окружающем растворе возникают локальные токи: между участками поверхности мембраны с большим потенциалом (положительно заряженными) и участками с меньшим потенциалом (отрицательно заряженными).
Локальные токи образуются и внутри аксона, и на наружной его поверхности. Локальные электрические токи приводят к повышению потенциала внутренней поверхности невозбужденного участка мембраны φвн и к понижению φнар наружного потенциала невозбужденного участка мембраны, оказавшегося по соседству с возбужденной зоной. Таким образом, отрицательный потенциал покоя φп уменьшается по абсолютной величине, то есть повышается. В областях, близких к возбужденному участку,φм повышается выше порогового значения. Под действием изменения мембранного потенциала открываются натриевые каналы и дальнейшее повышение происходит уже за счет потока ионов натрия через мембрану.
Происходит деполяризация мембраны, развивается потенциал действия. Затем возбуждение передается дальше на покоящиеся участки мембраны.
Может возникнуть вопрос, почему возбуждение распространяется по аксону не в обе стороны от зоны, до которой дошло возбуждение, ведь локальные токи текут в обе стороны от возбужденного участка. Дело в том, что возбуждение может распространяться только в область мембраны, находящуюся в состоянии покоя, то есть в одну сторону от возбужденного участка аксона. В другую сторону нервный импульс не может распространяться, так как области, через которые прошло возбуждение, некоторое время остаются невозбудимыми - рефрактерными.
Повышение мембранного потенциала - величина деполяризующего потенциала V, передаваемого от возбужденных участков вдоль мембраны, зависит от расстояния х (как это следует из электродинамики) по формуле:

V0 - повышение мембранного потенциала в зоне возбуждения, х - расстояние от возбужденного участка; λ, - константа длины нервного волокна, равная расстоянию, на котором деполяризующий потенциал уменьшается в е раз...
Константа длины нервного волокна
 ,
,
где rm - удельное электрическое сопротивление оболочки волокна. δ - толщина оболочки, а - радиус нервного волокна, ri. - удельное электрическое сопротивление цитоплазмы. Чем больше константа длины мембраны, тем больше скорость распространения нервного импульса. Величина λ тем больше, чем больше радиус аксона и удельное сопротивление мембраны и чем меньше удельное сопротивление цитоплазмы.
Большую скорость распространения нервного импульса по аксону кальмара обеспечивает их гигантский по сравнению с аксонами позвоночных диаметр. У позвоночных большая скорость передачи возбуждения в нервных волокнах достигается другими способами. Аксоны позвоночных снабжены ми-елиновой оболочкой, которая увеличивает сопротивление мембраны и ее толщину.
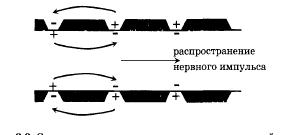
Рис.20. Сальтаторное распространение потенциала действия по миелинизированному волокну
Возбуждение по миелинизированному волокну распространяется сальтаторно (скачкообразно) от одного перехвата Ранвье (участка, свободного от миелиновой оболочки) до другого. Нервные импульсы проводятся по аксонам в какой-то степени аналогично тому, как передаются электрические сигналы по кабельно-релейной линии. Электрический импульс передается без затухания за счет его усиления на промежуточных релейных станциях, роль которых в аксонах выполняют участки возбудимой мембраны, в которых генерируются потенциалы действия.
ГЛАВА 4. МЕХАНИЗМЫ ГЕНЕРАЦИИ ПОТЕНЦИАЛА ДЕЙСТВИЯ
Экспериментальной базой для создания модели генерации потенциала действия явились результаты опытов по разделению ионных токов возбужденного аксона
Для разделения токов использовали блокатор натриевого тока - тетродотоксин (ТТХ) и блокатор калиевого тока - тетраэтиламмоний (ТЭА).
Измерение входящих и выходящих токов проводилось в режиме фиксации потенциала. При введении в раствор тетродотоксина регистрировали временную зависимость выходящего тока К+, IK(t) При действии на мембрану тетрааэтиламмонием регистрировали временную зависимость входящего тока Na+, INa (t) при тех же значениях деполяризующего потенциала, что и для калиевого тока.
В серии опытов на аксоне кальмара было показано:
1) образование потенциала действия связано с переносом ионов Na+ и К+ через мембрану;
2) проводимость мембраны для этих ионов меняется в зависимости от величины мембранного потенциала и времени:
gNa(φM,t), gK(φM,t).
В дальнейшем Ходжкин и Хаксли предложили математическую модель, которая описывала изменения проводимостей, а следовательно, и токов ионов Na+ и К+ через мембрану в процессе возбуждения.
Основными постулатами этой модели являются:
1) в мембране существуют отдельные каналы для переноса ионов Na+и К+;
2) во внутренней структуре мембраны существуют некоторые заряженные частицы, управляющие проводимостью каналов. В зависимости от величины напряженности приложенного электрического поля эти гипотетические частицы могут передвигаться в мембране, и тем самым увеличивать или уменьшать потоки ионов Na+ и К+ через каналы.
Предполагается, что ионы калия могут проходить через канал, если к его участку под действием электрического поля подойдут одновременно четыре однозарядные частицы. Обозначим n - вероятность подхода одной такой частицы. Тогда проводимость ионов калия:
gK=gK∙n4
где gK - максимальная проводимость канала для ионов К+. Четвертая степень при n определялась эмпирически. Величина n4 объяснялась как вероятность нахождения одновременно четырех активирующих частиц в некотором определенном участке мембраны.
Изменение проводимости для ионов Na+ описывалось более сложным выражением. Для натриевого канала предполагалось, что он открывается, если одновременно в данный участок попадают три активирующие частицы и удаляется одна блокирующая. Тогда, обозначив m - вероятность прихода активирующей частицы, a h- вероятность удаления блокирующей, получаем:
gNa=gNa∙m3h
где gNa - максимальная проводимость канала для ионов Na+.
Здесь введены два типа частиц, активирующие и блокирующие, так как натриевый ток в условиях фиксированного потенциала сначала нарастает до максимума - активация, а затем уменьшается до 0 - инактивация. Степени при m и h также подбирались эмпирически, чтобы наилучшим образом описать кинетику токов. Численные значения n, m и h имеют смысл вероятности нахождения соответствующей частицы в данном месте канала, а величины их могут меняться от 0 (отсутствие частицы) до 1 (нахождение ее в заданном месте.
Физическая интерпретация модели Ходжкина-Хаксли требовала наличия внутри мембраны некоторых заряженных частиц, причем эти частицы должны передвигаться в зависимости от внешнего электрического поля. Таким образом, для подтверждения второго постулата модели необходимо было зарегистрировать перемещения заряженных частиц внутри мембраны при изменении мембранного потенциала, то есть зарегистрироватъ так называемые воротные токи. Трудное обнаружения воротных токов заключалась в том, что активирующих частиц внутри мембраны очень мало и, следовав но, мало значение воротного тока по сравнению с ионными токами, проходящими через мембрану.
Для обнаружения воротных токов с помощью блокаторов ТТХ и ТЭА, а также заменой ионов Na+ в наружном растворе на ионы триса, исключали ионные токи; затем ступеньками меняли напряжение на мембране и регистрировали появление воротного тока натриевого канала, который оказался в 103 слабее натриевого тока.
Изменение во времени воротного тока в аксоне кальмара было взаимосвязано с изменением натриевого тока. Таким образом: на опыте было показано существование воротных токов, предсказанных в модели Ходжкина-Хаксли.
Ионные каналы клеточных мембран
Модель возбудимой мембраны по теории Ходжкина-Хаксли предполагает регулируемый перенос ионов через мембрану. Однако непосредственный переход иона через липидный бислой весьма затруднен. Поэтому величина коэффициента распределения К в формулах очень мала, а следовательно, был бы мал и поток ионов, если бы ион переходил непосредственно через липидную фазу мембраны. Таким образом, непосредственный перенос ионов через липидный бислой только за счет диффузии маловероятен.
Можно предположить, что в мембране должны быть некоторые специальные структуры - проводящие ионы. Такие структуры были найдены и названы ионными каналами. Подобные каналы выделены из различных объектов: плазматической мембраны клеток, постсинаптической мембраны мышечных клеток и других объектов. Известны также ионные каналы, образованные антибиотиками.
Основные свойства ионных каналов:
1) селективность;
2) независимость работы отдельных каналов;
3) дискретный характер проводимости;
4) зависимость параметров каналов от мембранного потенциала.
Рассмотрим их по порядку.
1. Селективностью называют способность ионных каналов избирательно пропускать ионы какого-либо одного типа.
Еще в первых опытах на аксоне кальмара было обнаружено что ионы Na+ и К+ по-разному влияют на мембранный потенциал. Ионы К+ меняют потенциал покоя, а ионы Na+ - потенциал действия. В модели Ходжкина-Хаксли это описывается путем введения независимых калиевых и натриевых ионных каналов. Предполагалось, что первые пропускают только ионы К+, а вторые - только ионы Na+.
Измерения показали, что ионные каналы обладают абсолютной селективностью по отношению к катионам (катион-селективные каналы) либо к анионам (анион-селективные каналы). В то же время через катион-селективные каналы способны проходить различные катионы различных химических элементов, но проводимость мембраны для неосновного иона, а значит, и ток через нее, будет существенно ниже, например, для Na+-кaнала калиевый ток через него будет в 20 раз меньше. Способность ионного канала пропускать различные ионы называется относительной селективностью и характеризуется рядом селективности - соотношением проводимостей канала для разных ионов, взятых при одной концентрации. При этом для основного иона селективность принимают за 1. Например, для Na+-канала этот ряд имеет вид:
Na+:K+= 1:0,05.
2. Независимость работы отдельных каналов. Прохождение тока через отдельный ионный канал не зависит от того, идет ли ток через другие каналы. Например, К+-каналы могут быть включены или выключены, но ток через Nа+-каналы не меняется. Влияние каналов друг на друга происходит опосредованно: изменение проницаемостей каких-либо каналов (например, натриевых) меняет мембранный потенциал, а уже он влияет на проводимости прочих ионных каналов.
3. Дискретный характер проводимости ионных каналов. Ионные каналы представляют собой субъединичный комплекс белков, пронизывающий мембрану. В центре его существует трубка, сквозь которую могут проходить ионы. Количество ионных каналов на 1 мкм2 поверхности мембраны определяли с помощью радиоактивномеченного блокатора натриевых каналов - тетродотоксина. Известно, что одна молекула ТТХ связывается только с одним каналом. Тогда измерение радиоактивности образца с известной площадью позволило показать, что на 1 мкм2 аксона кальмара находится около 500 натриевых каналов. Те трансмембранные токи, которые измеряют в обычных экспериментах, например, на аксоне кальмара длиной 1 см и диаметром 1 мм, обусловлены суммарным ответом (изменением проводимости) 500 • 3 • 107 - 1010 ионных каналов. Для такого ответа характерно плавное во времени изменение проводимости. Ответ одиночного ионного канала меняется во времени принципиально иным образом: дискретно и для Na+-каналов, и для К+-, и для Са2+-каналов.
Результаты экспериментов, выполненных на различных ионных каналах, показали, что проводимость ионного канала дискретна и он может находиться в двух состояниях: открытом или закрытом. Переходы между состояниями происходят в случайные моменты времени и подчиняются статистическим закономерностям. Нельзя сказать, что данный ионный канал откроется именно в этот момент времени. Можно лишь сделать утверждение о вероятности открывания канала в определенном интервале времени.
Рассмотрим токи через одиночные Ка+-каналы.
Канал за время одного такого деполяризующего сдвига открывался лишь один раз на время tи, которое будем называть временем открытого состояния канала.
Среднее значение tи для Na+-канала ≈ 0,7 мс (от 0,3 до 1,5 мс).
Одиночный канал может открыться раньше (1-й опыт) или позже (N-й опыт). Время, в течение которого вероятность открывания отдельного канала велика, будем называть временем жизни каналов: TNa, ТСа. Для натриевых каналов TNa≈ 2 мс.
Таким образом, процесс открытия натриевых каналов - процесс стохастический: сдвиг φм выше порогового значения увеличивает вероятность открывания каналов, то есть идет процесс их активации. По прошествии времени жизни каналов TNa вероятность их открывания падает до нуля и этот процесс называется инактивацией Na+-токa.
Несмотря на то, что ток через каждый ионный канал меняется скачком, зависимость суммарного трансмембранного тока во времени плавная Этот феномен можно объяснить, используя методы статистической физики.
Суммарный ток I через N одиночных ионных каналов:
I=  ,
,
где in – ток через n-й канал.
Среднее значение I суммарного тока в случае одинаковых каналов определяется средним током i в каждом канале:

Относительная флуктуация тока в одиночном канале велика:

При больших N относительные флуктуации ничтожны. Для совокупности N = 1010 ионных каналов, расположенных на участке аксона кальмара, флуктуация тока составляет 10-5 (0,001 %) от среднего значения тока через мембрану, то есть флуктуации тока при измерениях в этом случае практически не заметны. Для маленьких клеток, в которых может быть порядка 103 ионных каналов, относительные флуктуации более существенны.
Токи одиночных К+-каналов имеют амплитуду до 2 пА, а среднее время открытого состояния ta ≈ 5 мс. Однако за это время канал может несколько раз открыться и закрыться на короткое время, то есть могут происходить осцилляции тока. В отличие от натриевых, К+-каналы не инактивируются, пока φм выше порогового значения. Отдельные каналы во время деполяризации могут открываться по нескольку раз.
Токи одиночных Са2+-каналов кардиомиоцитов имеют более сложный характер по сравнению с Na+- и К+-токами аксонов. Во время последовательных скачков деполяризации в 70 % случаев Са2+-канал открывается на время ~ 1 мс; затем через каждые 0,2 мс он закрывается и вновь открывается и пропускает ток с амплитудой импульса ≈ 1 пА. Такой процесс активации Са2+-тока длится около 130 - 200 мс, а затем наступает инактивация Са2+-тока. В 30 % скачков деполяризаций кальциевый канал остается закрытым.
4. Зависимость параметров канала от мембранного потенциала Ионные каналы нервных волокон чувствительны к мембранному потенциалу, например натриевый и калиевый каналы аксона кальмара. Это проявляется в том, что после начала деполяризации мембраны соответствующие токи начинают изменяться. Ион-селективный канал имеет сенсор - некоторый элемент своей конструкции, чувствительный к действию электрического поля. При изменении мембранного потенциала меняется величина действующей на него силы, в результате эта часть ионного канала перемещается и меняет вероятность открывания или закрывания ворот - своеобразных заслонок, действующих по закону "все или ничего". Экспериментально показано, что под действием деполяризации мембраны увеличивается вероятность перехода натриевого канала в проводящее состояние. Скачок напряжения на мембране, приводит к тому, что большое число каналов открывается. Через них проходит больше зарядов, а значит, в среднем, протекает больший ток. Существенно, что процесс роста проводимости канала определяется увеличением вероятности перехода канала в открытое состояние, а не увеличением диаметра открытого канала. Таково современное представление о механизме прохождения тока через одиночный канал.
Плавные кинетические кривые токов, регистрируемых при электрических измерениях на больших мембранах, получаются вследствие суммации многих скачкообразных токов, протекающих через отдельные каналы. Их суммирование, как показано выше, резко уменьшает флуктуации и дает достаточно гладкие зависимости трансмембранного тока от времени.
Ионные каналы могут быть чувствительны и к другим физическим воздействиям: механическим деформациям, связыванию химических веществ и т.д. В этом случае они являются структурной основой, соответственно, механорецепторов, хеморецепторов и т.д.
Изучение ионных каналов в мембранах есть одна из важнейших задач современной биофизики.
1) Потенциалоуправляемые каналы.

«Ворота» канала системой «рычагов» соединены с диполем, который может поворачиваться, открывая или закрывая ворота. «якорные части» фиксируют положение белка в мембране (в незакреплённом состоянии белок способен совершать латеральное движение по мембране.
2) Прямо-хемуправляемые каналы.

На белок садится некий интермедиат, меняя его конформацию, вследствие чего канал открывается. После отделения интермедиата от белка, канал закрывается.
3) Коственно-хемоуправляемые каналы.
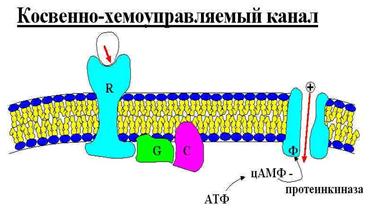
Состоят из нескольких белковых фракций. На R-белок садится некое вещество (например гормон), вызывая конформационные изменения этого белка. R-белок «мехаически» взаимодействует с G-белком, который, в свою очередь, взаимодействует с С-белком. С-белок осуществляет реакцию АТФ ® цАМФ + 2Ф и активизирует протеинкиназу, присоединяя Ф к белку-каналу, после чего канал открывается.
4) Электрическиуправляемые каналы. (Чаще встречаются в возбудимых тканях).
|
|
|
|
|
|
Рефрактерный период – время, в течение которого невозможно возбуждение клетки.
В основе потенциала действия лежит нелинейная зависимость тока от потенциала. Весь процесс возникновения можно воспринимать как разрядку ёмкости, или перезарядку конденсатора. Действительно, поле внутри клетки можно считать постоянным, мембрана несёт некий потенциал, после возникновения потенциала действия мембрана приобретает потенциал обратного знака, после чего относительно долго релаксирует к начальному состоянию.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1851; Нарушение авторских прав?; Мы поможем в написании вашей работы!