
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные стадии гетерогенных процессов
|
|
|
|
Кинетика гетерогенных процессов.
4.4.1 Типы гетерогенных процессов
Гетерогенные реакции, в отличие от гомогенных, протекают при нахождении реагентов более чем в одной фазе. Поверхность, отделяющая одну фазу от другой, называется поверхностью раздела фаз, или интерфейсом. Через эту поверхность реагенты должны переноситься. Поверхность раздела фаз, или интерфейс, является границей между фазами. Например, в реакциях «твердое-газ» интерфейс есть внешняя поверхность твердого тела, находящаяся в контакте с газом. Для двух несмешивающихся жидкостей интерфейс есть поверхность контакта двух жидкостей.
Гетерогенные процессы протекают обычно при учсатии следующих стадий:
1. Транспорт реагентов к границе раздела фаз.
2. Сорбция реагентов на границе раздела фаз..
3. Химическая реакция на поверхности раздела фазю
4. Десорбция продуктов реакции с границы раздела фах.
5. Транспорт продуктов реакции в глубину сплошной фазы
На общую скорость процесса накладываются скорости отдельных стадий.
Транспорт реагентов к границе раздела фаз описывается с помощью закономерностей массопередачи.
Основное уравнение для описания скорости массопередачи выглядит следующим образом:
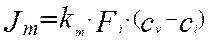 (4.4.1)
(4.4.1)
Где:
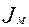 – массовый поток к поверхности интерфейса, кмоль/мин
– массовый поток к поверхности интерфейса, кмоль/мин
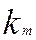 - коэффициент массопередачи, м/мин
- коэффициент массопередачи, м/мин
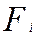 - площадь поверхности интерфейса, м2
- площадь поверхности интерфейса, м2
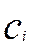 - концентрация реагента на границе раздела фаз, кмоль/м3
- концентрация реагента на границе раздела фаз, кмоль/м3
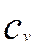 - концентрация реагента в объеме сплошной фазы, кмоль/м3
- концентрация реагента в объеме сплошной фазы, кмоль/м3
2. Скорость сорбции на поверхности раздела фаз по закону Генри буде пропорциональна концентрации у поверхности раздела фаз, при этом коэффициент пропорциональности – константа Генри будет зависеть от природы вещества и температуры. Этот процесс протекает обычно достаточно быстро, и поверхностная концентрация может быть записана следующим образом:

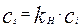 (4.4.2)
(4.4.2)
Скорость реакции на поверхности будет равна произведению константы скорости реакции на концентрацию реагента на поверхности раздела фаз.
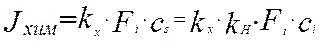 (4.4.3)
(4.4.3)
При отсутствии накопления реагента на границе раздела фаз поток вещества, переносимого к поверхности раздела фаз за счет массопередачи будет равен потоку вещества, вступающего в химическую реакцию. Приравняв эти потоки, получим уравнение материального баланса.
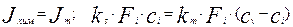 (4.4.4)
(4.4.4)
Где 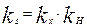
Разрешив это уравнение относительно концентрации на поверхности раздела фаз 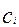 , получим выражение для
, получим выражение для 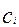 :
:
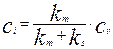 (4.4.5)
(4.4.5)
Подставив это выражение в уравнение для скорости гетерогенной реакции на поверхности раздела фаз (4.4.3), получим уравнение для скорости гетерогенной реакции, выраженное через концентрацию реагента в объеме сплошной фазы 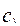 :
:
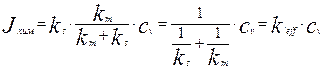 (4.4.6)
(4.4.6)
Где 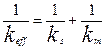 (4.4.7)
(4.4.7)
Уравнение (4.4.7) выражает аддитивность сопротивлений отдельных стадий гетерогенного процесса. Если 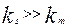 химическое сопротивление много больше сопротивления массопередачи и скорость переноса массы к поверхности раздела фаз лимитирует общую скорость процесса. В этом случае говорят, что процесс протекает в диффузионной области. При условии, когда
химическое сопротивление много больше сопротивления массопередачи и скорость переноса массы к поверхности раздела фаз лимитирует общую скорость процесса. В этом случае говорят, что процесс протекает в диффузионной области. При условии, когда 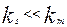 , скорость массопередачи много больше скорости реакции на поверхности раздела фаз и процесс протекает в кинетической области. Если константы скорости отдельных стадий соизмеримы,
, скорость массопередачи много больше скорости реакции на поверхности раздела фаз и процесс протекает в кинетической области. Если константы скорости отдельных стадий соизмеримы, 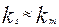 , процесс
, процесс
протекает в смешанной, диффузионно-кинетической области.
4.4.3.Определение области протекания
гетерогенного процесса.
Область гетерогенного процесса можно определить по зависимости эффективной скорости процесса  от условий протекания процесса.
от условий протекания процесса.
· По зависимости наблюдаемой скорости процесс от относительной скорости движении фаз.
Если наблюдаемая скорость процесс зависит от скорости движения фаз, то общая скорость процесса контролируется скоростью массопереноса. Это означает, что 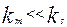 и процесс происходит в диффузионной области, так как скорость массопередачи увеличивается при увеличении скорости обтекания твердой фазы, за счет уменьшения толщины диффузионного пограничного слоя, в соответствии с уравнениями, вытекающими из 1-гозакона Фика. Лимитирующей стадией процесса при протекании процесса в диффузионной области является скорость диффузии через неподвижный диффузионный слой на поверхности раздела фаз:
и процесс происходит в диффузионной области, так как скорость массопередачи увеличивается при увеличении скорости обтекания твердой фазы, за счет уменьшения толщины диффузионного пограничного слоя, в соответствии с уравнениями, вытекающими из 1-гозакона Фика. Лимитирующей стадией процесса при протекании процесса в диффузионной области является скорость диффузии через неподвижный диффузионный слой на поверхности раздела фаз:
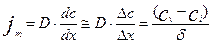 (4.4.8)
(4.4.8)
Где 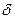 - толщины диффузионного пограничного слоя, которая зависит от скорости обтекания.
- толщины диффузионного пограничного слоя, которая зависит от скорости обтекания.
Например, на рис. Показано влияние скорости перемешиваниия на скорость растворения цинка в кислоте
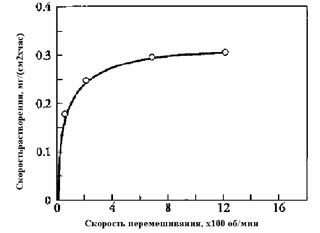
Рис.4.4.1. Зависимость скорости растворения цинка от скорости вращения мешалки.
Из рисунка видно, что при увеличении скорости вращения мешалки до»800 об/мин дальнейшее увеличение скорости растворения практически прекращается. Причиной этого может быть переход процесса в кинетическую область, где скорость процесс не зависит от скорости транспорта реагента к поверхности раздела фаз, на которой происходит химическое превращение.
Другим способом определения области протекания гетерогенного процесса является исследование зависимости общей скорости процесса от температуры.
Известно, что энергия активации химических процессов находится обычно в интервале 40¸200 кДж/моль. В то время как энергия активации диффузионных процессов, протекающих в жидких или газообразных средах находится в пределах 4¸20 кДж/моль
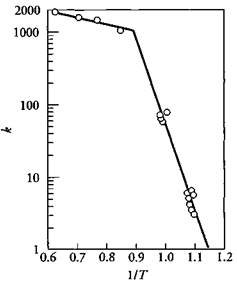
Рис.4.4.2: Влияние температуры на реакцию C+½O2→CO. В интервале температур 600-800°C, E=174 кДж/моль (химический контроль), и в интервале 1100-1300°C, E=6.3 кДж/моль (диффузионный контроль)
На рис.4.4.2 показано влияние температуры на реакцию окисления углерода при недостатке кислорода. Из рисунка видно, что в интервале температур 600-800°C, поверхностная реакция окисления является боле медленной стадией, чем скорость транспорта кислорода к реакционной поверхности. При достижении температуры 1000°С скорость поверхностной реакции увеличивается настолько, что скорость транспорта кислорода к реакционной поверхности становится медленнее возможной скорости его расхода и гетерогенный процесс окисления переходит в область диффузионного контроля.
Влияние формы межфазной поверхности раздела фаз на скорость гетерогенных процессов.
Форма твердого вещества, подвергаемого реакции в жидкой или газовой фазе играет важную роль в определении скорости процесса. Если твердое вещество имеет форму пластины или диска, площадь поверхности будет оставаться постоянной в ходе реакции и, следовательно, скорость процесса также будет постоянной. Однако, если твердое вещество имеет форму сферы или таблетки, поверхность будет непрерывно изменяться в ходе реакции и, следовательно, скорость будет также изменяться. Если это изменение ввести в рассмотрение, можно предсказать изменение скорости процесса по мере его протекания
Рассмотрим реакцию «твердое-жидкость», например реакцию растворения металла в кислоте.
Скорость растворения твердых частиц металла в кислоте может быть описана уравнением:
 (4.4.9)
(4.4.9)
где W-масса металла в произвольный момент времени, кг
А – поверхность частиц металла, м2.
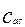 концентрация кислоты на поверхности раздела фаз
концентрация кислоты на поверхности раздела фаз
Пусть частицы металла имеют сферическую форму радиуса r. Тогда
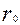 - радиус частицы в начальный момент времени, м
- радиус частицы в начальный момент времени, м
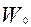 - масса частиц в начальный момент времени, кг
- масса частиц в начальный момент времени, кг
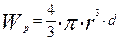 - масса одной частицы в произвольный момент времени, кг
- масса одной частицы в произвольный момент времени, кг
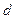 - плотность частицы, кг/м3.
- плотность частицы, кг/м3.
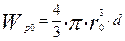 - масса частицы в начальный момент времени, кг
- масса частицы в начальный момент времени, кг
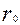 - радиус частицы в начальный момент времени, м.
- радиус частицы в начальный момент времени, м.
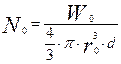 - число частиц в начальный момент времени.
- число частиц в начальный момент времени.
Допуская, что число частиц в процессе не изменяется, а изменяется только масса частицы, можно получить следующее выражение для текущей массы частицы:
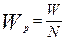 - где W – текущая масса частиц в любой момент времени, кг
- где W – текущая масса частиц в любой момент времени, кг
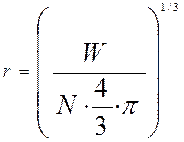 -радиус частицы в произвольный момент времени, м
-радиус частицы в произвольный момент времени, м
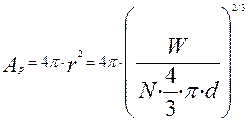 -поверхность частицы в произвольный момент времени, м2.
-поверхность частицы в произвольный момент времени, м2.
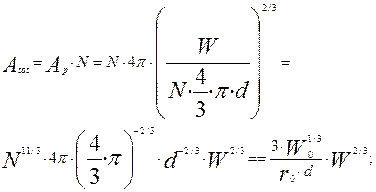
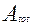 -общая поверхность всех частиц при текущей массе частиц W, м2.
-общая поверхность всех частиц при текущей массе частиц W, м2.
Обозначим через 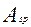 удельную поверхность частиц- поверхность, приходящую на единицу объем реактора, получим следующее уравнение, выражающее ее величину как функцию текущей массы металла:
удельную поверхность частиц- поверхность, приходящую на единицу объем реактора, получим следующее уравнение, выражающее ее величину как функцию текущей массы металла:
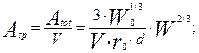 (4.4.11)
(4.4.11)
- удельная поверхность частиц, м2/м3.
Подставляя это значение удельной поверхности в уравнения для скоростей отдельных стадий процесса, записанного как для гомогенной реакции, мы получим уравнение скорости реакции, протекающей на поверхности твердой фазы, содержащейся в единице реакционного объем:
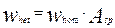 (4.4.12)
(4.4.12)
Где 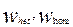 - скорость гетерогенной и гомогенной реакций, соответственно.
- скорость гетерогенной и гомогенной реакций, соответственно.
Выразим теперь текущее значение веса твердого реагента через его мольную концентрацию и объем реактора:

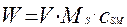 (4.4.13)
(4.4.13)
Ms – молекулярная масса твердой фазы, кг|кмоль
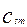 - мольная концентрация твердой фазы в объеме реактора, кмоль/м3.
- мольная концентрация твердой фазы в объеме реактора, кмоль/м3.
Продифференцировав обе части уравнения (12) по времени, с учетом уравнения (11),получим выражение для скорости изменения веса твердого реагента:
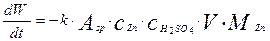 (4.4.14)
(4.4.14)
Где 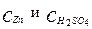 имеют размерность кг/м3.
имеют размерность кг/м3.
Используя уравнение (4.4.12) можно записать уравнения математической модели для остальных компонентов в следующем виде:
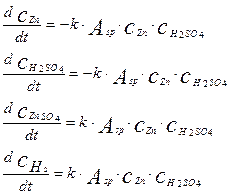 (4.4.15)
(4.4.15)
Таким образом, для получения математической модели гетерогенного процесса с использованием с использованием квазигомогенной модели можно использовать программный комплекс ReactOp, создав нестандартную модель следующим образом:
- Записать уравнения химических реакций для всех стадий.
- Записать уравнение для текущего значения массы твердой фазы(если она изменяется.
- Записать выражение для удельной поверхности контакта фаз.
- Умножить скорости изменения концентраций компонентов, полученные в программе ReactOp на величину удельной поверхности контакта фаз.
Эта процедура занимает немного времени и выполняется очень просто с использованием алгоритмического языка Fortran, близком к языку обычной записи математических формул.
Раздел 5. Синтез моделей технологических объектов на базе их гидродинамических моделей и уравнений химической кинетики.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 7689; Нарушение авторских прав?; Мы поможем в написании вашей работы!