
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные правила работы с термометрами 3 страница
|
|
|
|
При растворении смолистых веществ их разрезают на небольшие кусочки и постепенно вводят в растворитель. При растворении высокомолекулярных веществ первой стадией является набухание, а затем идет растворение.
Для приготовления растворов берут только чистые растворители. Если растворителем служит вода, то можно применять дистиллированную или деминерализованную воду, а в отдельных случаях бидистиллят или специально очищенную дистиллированную воду. Посуда – стаканы или колбы должны быть чистыми. Для растворения следует применять по возможности чистые вещества.
Для приготовления приблизительных растворов можно использовать технические вещества, взвешивать на технических весах, отмеривать растворы пипетками, ведя пересчет по справочным данным по плотности.
Для приготовления точных растворов берут химически чистые препараты, взвешивание ведется на аналитических весах, разбавление проводят в мерных колбах. Для быстрого приготовления точных растворов применяют стандарт-титры (фиксаналы) - заранее приготовленные и запаянные в ампулы точные количества реактива, необходимые для приготовления раствора заданной концентрации.
При приготовлении водных растворов жидкостей берут определенные объемы жидкостей, отмеряя их с помощью мерного цилиндра или пипеток.
При приготовлении растворов после добавления всех составляющих их тщательно перемешивают, путем кругового вращения колбы, с помощью стеклянной палочки или механического встряхивателя.
Растворение веществ в органических растворителях отличается от растворения в воде. Если используется летучий растворитель (диэтиловый эфир, ацетон, петролейный эфир и т.п.), нужно обеспечить условия, чтобы он не улетучился. Если растворяют в сухих (безводных) растворителях, то необходимо предотвратить попадание в растворитель влаги из воздуха.
Если вещество легко растворяется, то растворение ведут в сосуде с притертой пробкой. Вначале в сосуд вводят растворяемое вещество, затем добавляют растворитель, закрывают пробку, и несколько раз встряхивают.
Если же растворение идет медленно, то раствор готовят в специальном приборе с мешалкой. Мешалки бывают самых разнообразных видов. Мешалки присоединяют к электродвигателю через регулятор напряжения, позволяющий изменять скорость вращения мешалки.
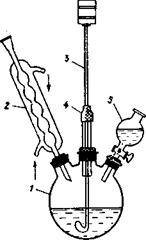
Для ускорения растворения часто применяют нагревание, тогда к колбе присоединяют обратный холодильник для исключения испарения растворителя. Ниже на рисунке показаны приборы с мешалками, установленными различным способом. Приборы включают реакционную колбу 1, обратный холодильник 2, мешалку 3, резиновый уплотнитель 4, капельную воронку 5.
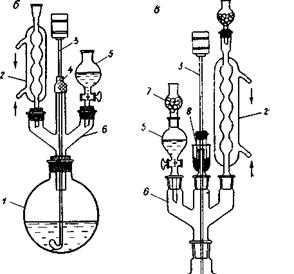 Прибор а собран на трехгорловой колбе, прибор б собран с помощью простой круглодонной колбы и трехрогового форштоса 6. Прибор в оснащен хлоркальцевыми трубками 7 для предотвращения контакта с влагой воздуха и гидрозатвором 8 для герметизации места ввода мешалки в сосуд.
Прибор а собран на трехгорловой колбе, прибор б собран с помощью простой круглодонной колбы и трехрогового форштоса 6. Прибор в оснащен хлоркальцевыми трубками 7 для предотвращения контакта с влагой воздуха и гидрозатвором 8 для герметизации места ввода мешалки в сосуд.
|
Примеры приборов для работы с механическими мешалками.
Ниже показаны типы стеклянных мешалок.
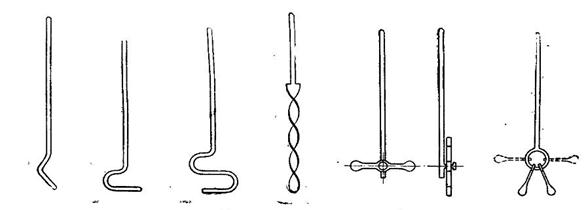
Для вращения мешалок применяют кроме электрических моторов, водяные турбины, воздушные моторы, приводимые в движение нагретым воздухом.
Рассмотренные выше приборы применимы и для проведения синтеза веществ. Реакции можно проводить несколькими способами в зависимости от природы веществ: 1) требуемые навески сразу смешиваются в реакционном сосуде перед началом реакции, 2) чаще всего один реагент помещают в реакционный сосуд, а второй постепенно добавляют в ходе реакции через капельную воронку, 3) в редких случаях оба реагента добавляют постепенно в ходе реакции (в этом случае необходимо установить 2 капельных воронки).
Твердое вещество вводят с помощью воронки для твердых веществ. Перемешивание можно вести и с помощью магнита, запаянного в капсулу и магнитной мешалки, тогда колба обогревается через масляную баню. Применение магнитной мешалки предпочтительно при проведении реакций без доступа влаги.
Для проведения реакций в безводной среде устанавливаются хлоркальциевые трубки на обратных холодильниках и капельных воронках. Обычно в качестве заполнителя используют силикагель, изменяющий свою окраску от голубой в сухом состоянии до розовой, когда необходима его регенерация. Можно использовать хлорид кальция, помещенный между двумя пробками из стекловаты. Стеклянная посуда для проведения таких реакций должна быть тщательно высушена при 140оС, шлифы смазаны и хорошо притерты, установку собирают пока стеклянные сосуды горячие, а охлаждение ведут с установленными хлоркальцевыми трубками.
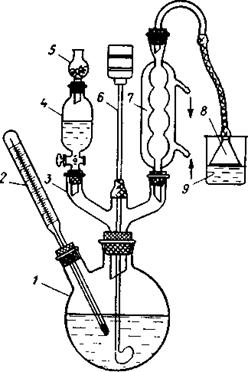
Почти все препаративные реакции проводят в жидкой фазе. Поэтому важно знать температур кипения растворителя и контролировать температуру синтеза. На рисунке ниже изображен типичный прибор для проведения синтеза с установленным термометром. Вместо термометра иногда вводится источник пара для перегонки с паром. Газы, выходящие через холодильник, можно улавливать поглотителем 9 с помощью химической воронки 8.
|
При проведении реакции в инертной среде, осуществляют продувку установки сухим инертным газом, обычно азотом. Для этого должно быть предусмотрено место подачи газа, т.е. еще один отросток на колбе. Вывод азота осуществляется через барботер, устанавливаемый на выходе из холодильника. Существует целый ряд приемов, обеспечивающих проведение реакций с реагентами, чувствительными к влаге и кислороду воздуха. Основная трудность при этом состоит в перенесении реакционноспособных жидкостей и твердых веществ. Для этого разработаны специальные устройства и правила.
24. АДСОРБЦИЯ И ЕЕ ПРИМЕНЕНИЕ В ЛАБОРАТОРНОЙ ПРАКТИКЕ
Под адсорбцией понимается процесс поглощения растворенного, жидкого или газообразного вещества сильно развитой поверхностью адсорбента. Процессы адсорбции широко применяются в химической практике, например адсорбция кофеина на активной глине, обесцвечивание окрашенных органических жидкостей, удаление примесей из растворов, очистка воздуха.
Адсорбенты разделяют на два типа:
1. Гидрофобные, или неполярные, адсорбенты лучше всего поглощают растворенное вещество из полярных растворителей, особенно из водных растворов. Типичным примером такого рода адсорбента является активированный уголь.
2. Гидрофильные, или полярные, адсорбенты дают лучшие результаты при применении неполярных или малополярных растворителей. К этой группе относятся силикагель, активные глины (алюмосилликаты), оксид алюминия (вернее частично дегидратированный гидрат оксида алюминия).
Адсорбенты могут быть нейтральными или же обладать кислотными или основными свойствами. Нейтральные адсорбенты: карбонат кальция, сульфат магния, сахароза. Основные адсорбенты: оксид алюминия, оксид магния, оксид кальция. Кислотные адсорбенты: силикагель, алюмосиликаты (активные глины). Свойства оксида алюминия и некоторых активных глин могут меняться в зависимости от того, чем они были предварительно обработаны: кислотами или щелочами. Поэтому эти вещества скорее относятся к амфотерным адсорбентам.
Существует целый ряд синтетических адсорбентов – это ионообменные смолы, представляющие собой полимерные вещества, содержащие разнообразные кислотные или основные функциональные группы. В зависимости от вида группы ионообменные смолы подразделяются на катиониты или аниониты.
При выборе условий опыта кроме характера адсорбента, следует учитывать степень его активности и емкость, определяемую величиной поверхности, отнесенной к единице массы или объема. Однако более существенную роль играет правильный выбор растворителя, поскольку в некоторых случаях сам растворитель может легче адсорбироваться, чем растворенное в нем вещество.
Некоторые адсорбенты, так называемые «молекулярные сита», поглощают из раствора вещества в зависимости от молекулярной массы. Они обладают большим объемом пор и адсорбируют только такие соединения, молекулы которых способны проникнуть в поры поглотителя. Молекулы большого размера такими адсорбентами не задерживаются.
В качестве «молекулярных сит» применяют некоторые природные алюмосиликаты, известные под названием цеолиты. Синтетические «молекулярные сита» или сефадексы представляют собой полимеры декстрана.
Для обесцвечивания окрашенных жидкостей или удаления примесей чаще всего применяют различные сорта активированного угля, которые обладают различной пористостью. Практически уголь адсорбирует в той или иной степени все вещества, поэтому применение его в больших количествах может привести к потере основного вещества, подвергаемого очистке.
Большое значение имеет кислотность (рН) среды. Амфотерные вещества адсорбируются лучше при рН от 3 до 6. Изменение рН не оказывает влияния на адсорбцию неэлектролитов. Активированный уголь всегда содержит довольно много влаги, поэтому если присутствие влаги должно быть исключено, необходимо предварительно его высушить, лучше всего в вакууме.
Кроме активированного угля, в качестве обесцвечивающих адсорбентов могут использоваться различные активные глины, силикагель, оксид алюминия.
Обычно для обесцвечивания раствор непродолжительное время нагревают с адсорбентом, после чего фильтруют. Того же результата можно достигнуть и без нагревания, оставив смесь при комнатной температуре примерно на сутки. Если процесс адсорбции протекает достаточно быстро, то целесообразно просто фильтровать обесцвечиваемую жидкость через слой адсорбента, находящегося на фильтре.
Явление различной адсорбируемости органических веществ положено в основу адсорбционной хроматографии. Принцип хроматографического раз 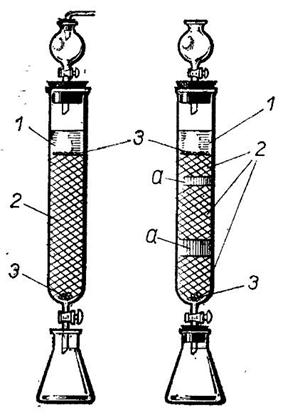 деления заключается в том, что при пропускании какого-то раствора или смеси жидких веществ через высокую, сравнительно узкую колонку, заполненную адсорбентом, вещества поглощаются в зависимости от степени адсорбируемости, в определенной последовательности, но в то же время обратимо.
деления заключается в том, что при пропускании какого-то раствора или смеси жидких веществ через высокую, сравнительно узкую колонку, заполненную адсорбентом, вещества поглощаются в зависимости от степени адсорбируемости, в определенной последовательности, но в то же время обратимо.
В стеклянную трубку (можно бюретку) на дно перед сужением помещают кусочек стеклянной ваты 3. Сорбент 2 засыпают мелкими порциями в предварительно налитый растворитель, или же заливают сильно взмученную суспензию сорбента в растворителе. Верхнюю часть сорбента также закрывают тампоном из стеклянной ваты. После того как растворитель стечет и достигнет верхнего края сорбента (колонка никогда не должна оставаться сухой), через колонку пропускают исследуемый раствор. Затем заливают чистый элюент, при пропускании которого происходит разделение веществ на цветные зоны (а).
25. РЕАКТИВЫ. ВОЗМОЖНЫЕ ВИДЫ ОПАСНОСТИ ПРИ РАБОТЕ С ХИМИЧЕСКИМИ ВЕЩЕСТВАМИ
Работа в химической лаборатории неразрывно связана с применением химических реактивов. По своему назначению реактивы могут быть разделены на две основные группы: общеупотребительные и специальные.
Общеупотребительные реактивы имеются в любой лаборатории, к ним относятся кислоты (соляная, азотная, серная), щелочи (раствор аммиака, едкий натр, едкий калий), оксиды кальция и бария, ряд солей (например, хлориды натрия, кальция, аммония, сульфаты меди, бария, аммония, нитраты натрия, аммония, серебра), индикаторы (метиловый оранжевый, фенолфталеин).
Специальные реактивы применяются только для определенных работ.
По чистоте реактивы делятся на химически чистые (х.ч), чистые для анализа (ч.д.а.), чистые (ч). Кроме того, имеются реактивы кондиций технические (техн.), очищенные (оч.), особой чистоты (ос.ч), высшей очистки (в.оч.) и спектрально чистые (сп.ч.). Для реактивов каждой их категорий установлено определенное допустимое содержание примесей.
Наиболее употребительные реактивы, например кислоты могут быть расфасованы в бутылях по 20 литров. Переносить и хранить такие бутыли необходимо в деревянных обрешетках. Для переливания жидкостей необходимо применять сифоны. Простая конструкция сифона представляет собой резиновую пробку, в которую вставляются две стеклянные трубки, одна длинная должна быть погружена в жидкость, вторая короткая не касаться жидкости. Сверху трубок надеваются резиновые шланги. Шланг от длинной трубки вставляется в сосуд, куда необходимо отлить жидкость, а в шланг от короткой трубки нагнетается воздух, например резиновой грушей.
Иногда в качестве сифона применяют резиновую трубку, к нижнему концу которой присоединяют стеклянный тройник. На боковой отвод тройника одевают резиновую трубку с зажимом. Чтобы начать сифонирование, верхний конец сливной трубки опускают в жидкость и пальцем зажимают нижний открытый конец тройника. Открывают зажим и через боковую трубку резиновой грушей засасывают раствор. Как только жидкость заполнит боковой отвод тройника, зажим отпускают, отнимают палец от нижнего конца трубки и дают жидкости стечь.
Необходимо следить, чтобы на всех банках с реактивами были этикетки с обозначениями, что находится в банке, или надписи, сделанные карандашом по стеклу. Если на банке с реактивом нет этикетки или надписи, такой реактив использовать нельзя, так как это может привести к серьезным последствиям.
Твердые реактивы в банках могут слеживаться в плотные комки, которые трудно извлекать. Поэтому прежде чем брать твердый реактив из банки, нужно (при закрытой пробке) потрясти банку, ударяя ее, например ладонью по боку. Если слежавшийся реактив не рассыпается, тогда, открыв пробку, разрыхляют верхний слой фарфоровым шпателем или стеклянной палочкой. Металлический шпатель для этих целей применять не рекомендуется. Брать реактив из банки можно фарфоровыми ложкой или шпателем. Иногда используют совочек, изготовленный из бумаги.
Просыпавшийся на стол реактив никогда нельзя высыпать обратно в банку. Забота о сохранении чистоты реактивов – самое главное правило при работе с ними. Не следует путать пробки от склянок, содержащих различные реактивы.
При хранении гигроскопических веществ или веществ, которые могут изменяться под воздействием воздуха, банки должны быть герметизированы. Для этого пробки заливают парафином, менделеевской замазкой или сургучом. Реактивы, изменяющиеся под действием света (например, соли серебра), хранят в желтых или темных склянках, иногда вставленных в картонные коробки.
Есть реактивы, которые нельзя хранить в стеклянной таре. Например, для хранения фтористоводородной кислоты применяют полиэтиленовые бутыли.
Некоторые реактивы при продолжительном хранении изменяются или даже разлагаются. Например, анилин при хранении желтеет. Такие реактивы перед употреблением следует очистить или перегонкой, или фильтрованием через адсорбенты (активированный уголь), или другими приемами.
Некоторые реактивы способны самовоспламеняться, к ним относятся белый или желтый фосфор, пироформные металлы, металлорганические соединения (например, этилат алюминия). При этом хранить белый фосфор под слоем воды можно длительное время.
К огнеопасным реактивам относятся эфиры (диэтиловый, амиловый и др.), спирты (метиловый, этиловый, бутиловый и др.), углеводороды (бензин, газолин, петролейный эфир, керосин и др.), ароматические соединения (бензол, толуол, ксилол) сероуглерод, ацетон и др.
Самовоспламеняющиеся и огнеопасные вещества следует хранить только в специальной таре, в специально отведенных раздельных местах, при определенных условиях.
Нельзя хранить вместе вещества - окислители (марганцевокислый калий, перекись водорода, концентрированную хлорную и азотную кислоту) с веществами – восстановителями (уголь, сера, крахмал, фосфор и др.).
Взрывоопасными свойствами обладают соли хлорной кислоты, ацетилениды серебра и меди, азиды тяжелых металлов, нитросоединения, соли гремучей кислоты (H-O-N=C) и др. Все эти вещества требуют особых условий хранения. В лаборатории не должно быть большого запаса таких веществ.
Практически любое химическое вещество при попадании его в организм оказывает токсическое действие – отравление. Едкие химические вещества, например кислоты или щелочи, при попадании на кожу вызывают химические ожоги.
В лабораторной практике для многих химических соединений, природных продуктов или их смесей часто используют технические или торговые названия. Ниже дана расшифровка некоторых из них.
1. Адский камень – AgNO3, 27. Литопон – cмесь BaSO4 и ZnS,
2. Аммиачная селитра – NH4NO3, 28. Ляпис – AgNO3,
3. Английская соль–MgSO4x7H2O, 29. Магнезия жженая – MgO,
4. Белильная известь – CaOCl2, 30. Массикот – PbO,
5. Белый мышьяк - As2O3, 31. Медный купорос- CuSO4х5H2O,
6. Берлинская лазурь–Fe4[Fe(CN)6]3 32. Мел (мрамор) – СaCO3,
7. Бертолетова соль - KClO3, 33. Мумия - Fe2O3 с примесями,
8. Бланфикс - BaSO4, 34. Нашатырный спирт - водный
9. Бура - Na2B4O7x10H2O, раствор NH3 (NH4OH),
10. Гипосульфит – Na2S2O3x5H2O, 35. Нашатырь – NH4Сl,
11 Глет - PbO, 36. Норвежская селитра – Ca(NO3)2,
12. Горькая соль - MgSO4x7H2O, 37. Оксилит – Na2O2,
13. Едкий барий - BaOH, 38. Пергидроль–водн.р-р H2O2 (30%)
14. Едкий натр - NaOH, 39. Поташ – K2CO3,
15. Едкий кали - KOH, 40. Пушонка – Ca(OH)2,
16. Железный купорос–FeSO4x5H2O, 41. Серная печень – Na2S или K2S,
17. Желтая кровяная соль 42. Серный цвет – cера (S),
(желтое синькали) - K4Fe(CN)6, 43. Синий камень - CuSO4х5H2O,
18. Известь гашенная – Ca(OH)2, 44. Сода кальцинированная Na2CO3,
19. Известь негашеная (жженая), 45. Сода питьевая – NaHCO3,
кипелка – CaO, 46. Сулема – HgCl2,
20. Каломель – Hg2Cl2, 47. Сурик свинцовый – Pb3O4,
21. Карбид – CaC, 48. Тинкал - Na2B4O7x10H2O,
22. Карборунд – SiC, 49. Титановые белила – TiO2,
23. Каустик (каустич. сода)–NaOH, 50. Турнбулиева синь - Fe3[Fe(CN)6]2
24. Киноварь – HgS, 51. Хлорная известь – CaClO2,
25. Красная кровяная соль 52. Хромпик калиевый –K2Cr2O7,
(красное синькали) - K3Fe(CN)6, 53. Царская водка – смесь 1 объема
26. Купоросное масло – H2SO4, конц. HNO3 с 3 объемами конц. HCl,
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1102; Нарушение авторских прав?; Мы поможем в написании вашей работы!