
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественные меры вещества: атомные и молекулярные массы, моль. Закон Авогадро. Мольный объем газа
|
|
|
|
Задачи
Химический элемент и простое вещество, сложное вещество и смесь
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Под химическим элементом понимают совокупность атомов с одинаковым положительным зарядом ядра и с определенным набором свойств. Атомы одного и того же химического элемента, соединяясь, образуют простое вещество. При сочетании атомов разных химических элементов возникают сложные вещества (химические соединения) или смеси. Отличие химических соединений от смесей состоит в том, что:
· они обладают новыми свойствами, которых не было у простых веществ, из которых они были получены;
· их невозможно механически разделить на составные части;
· химические элементы в их составе могут быть только в строго определенных количественных соотношениях.
Некоторые химические элементы (углерод, кислород, фосфор, сера)способны существовать в виде нескольких простых веществ. Это явление носит название аллотропии, а разновидности простых веществ одного и того же химического элемента называются его аллотропными модификациями (видоизменениями).
1.1. Чего больше существует в природе: химических элементов или простых веществ? Почему?
1.2. Верно ли утверждение, что сера и железо в состав сульфида железа входят как вещества? Если нет, то какой правильный ответ?
1.3. Назовите аллотропные модификации кислорода. Отличаются ли они по своим свойствам? Как?
1.4. Какая из аллотропных модификаций кислорода химически более активна и почему?
1.5. Простыми веществами или химическими элементами являются цинк, сера и кислород в следующих реакциях:
1) 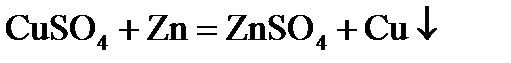 ;
;
2) 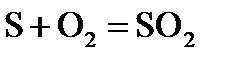 ;
;
3) 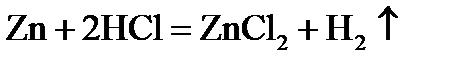 ;
;
4) 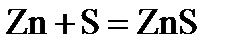 ;
;
5) 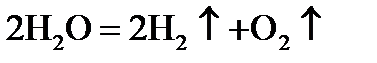 .
.
1.6. Можно ли из одного простого вещества получить другое простое вещество? Дать мотивированный ответ.
|
|
|
1.7. При сгорании некоторого вещества в кислороде получаются оксид серы (IV), азот и вода. Какие химические элементы образуют исходное вещество?
1.8. Указать, к простым или сложным веществам относятся: 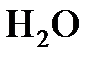 ;
; 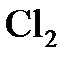 ;
; 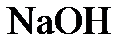 ;
; 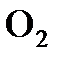 ;
;  ;
; 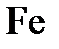 ;
; 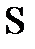 ;
; 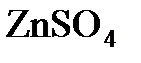 ;
; 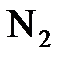 ;
; 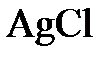 ;
; 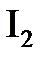 ;
; 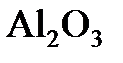 ;
; 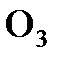 ?
?
1.9. Для каких химических элементов известны аллотропные модификации? Назовите эти модификации.
1.10. Возможен ли переход химического элемента из одной аллотропной модификации в другую? Привести примеры.
1.11. Какие химические элементы имеют в виду, когда говорят об алмазе, озоне?
1.12. Какие из веществ являются химическими соединениями, а какие - смесями:
а) почва; б) воздух; в) мел; г) серная кислота; д) вода?
1.13. Как доказать, что хлорид натрия относится к сложным веществам?
1.14. Назовите три аллотропных модификацииуглерода.
1.15. Как называются и чем отличаются друг от друга аллотропные модификации фосфора?
1.16. Как называются и чем отличаются друг от друга аллотропные модификации серы?
1.17. Указать, какое из утверждений верно и почему: в состав сульфата бария входят: а) простые вещества - барий, сера, кислород; б) химические элементы - барий, сера, кислород.
1.18. Сколько литров аммиака может быть получено из смеси 10 литров азота и 30 литров водорода?
1.19. Сколько литров водяного пара образуется из смеси 10 литров водорода и 4 литров кислорода? Какой газ и в каком объеме останется в избытке?
1.20. Сколько граммов сульфида цинка ( ) может образоваться из смеси 130 г цинка и 48 г серы?
) может образоваться из смеси 130 г цинка и 48 г серы?
В настоящее время единицей измерения масс атомов и молекул является атомная единица массы (1 а. е. м.= 1,66´1027 кг), равная 1/12 части массы изотопа углерода 12С. Относительной атомной массой элемента (или просто атомной массой) называют отношение массы его атома к 1/12 части массы атома 12С. Соответственно, относительной молекулярной массой простого или сложного вещества (или просто молекулярной массой) называют отношение массы его молекулы к 1/12 части массы изотопа углерода 12С.
|
|
|
Наряду с названным характеристиками в химии широко пользуются понятием количества вещества, единицей измерения которого служит моль. Моль - это количество вещества, которое содержит столько же молекул, атомов, ионов или других структурных единиц, сколько атомов содержится в 12 г изотопа углерода 12С. В 1 моле вещества содержится 6,02´1023 структурных единиц (постоянная или число Авогадро, обозначается буквой М, имеет размерность моль-1). Масса 1 моля вещества (мольная или молярная масса) численно равна его молярной массе, выраженной в граммах. Мольная масса выражается обычно в г/моль. Мольная масса М вещества равна отношению его массы 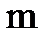 к количеству вещества n, выраженному в молях:
к количеству вещества n, выраженному в молях:
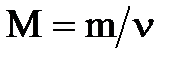 .
.
Рассмотрим решение задачи с использованием числа Авогадро.
Пример 1. Выразить массу одной молекулы 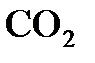 в граммах.
в граммах.
Решение. Относительная молекулярная масса диоксида углерода 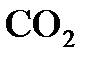 равна 44. Это означает, что его молярная масса равна 44 г/моль. В 1 моле
равна 44. Это означает, что его молярная масса равна 44 г/моль. В 1 моле 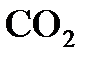 содержится 6,02´1023 молекул, откуда для массы одной молекулы можно записать соотношение:
содержится 6,02´1023 молекул, откуда для массы одной молекулы можно записать соотношение:
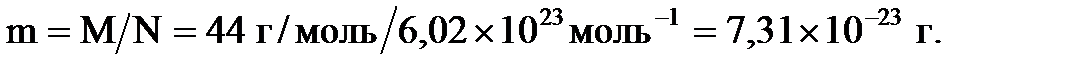
Ответ: Масса одной молекулы 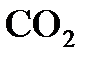 равна
равна 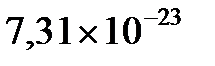 г.
г.
Для газов, кроме мольной массы, важную роль играет объем. Согласно закону Авогадро, в равных объемах любых газов при одной и той же температуре и при одном и том же давлении содержится одинаковое число молекул. Отсюда следует, что при одинаковых условиях 1 моль любого газа занимает один и тот же объем, называемый мольным объемом. При температуре 0°С и при давлении 101,325 кПа (нормальные условия) мольный объем любого газа равен 22,4 л.
Пример 2. Какой объем при нормальных условиях занимают 15 граммов диоксида углерода?
Решение. Объем 1 моля  при н.у. равен 22,4 л. Для определения искомого объема составим пропорцию, учитывая, что мольная масса
при н.у. равен 22,4 л. Для определения искомого объема составим пропорцию, учитывая, что мольная масса 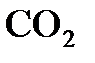 равна 44 г/моль:
равна 44 г/моль:
44 г 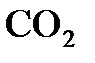 занимают при н.у. объем в 22,4 л,
занимают при н.у. объем в 22,4 л,
а 5 г 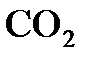 - х л,
- х л,
откуда находим: 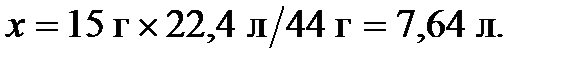
Ответ: 15 г 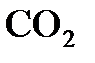 при н.у. занимают объем в 7,64 л.
при н.у. занимают объем в 7,64 л.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1151; Нарушение авторских прав?; Мы поможем в написании вашей работы!