
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эквивалентный объем
|
|
|
|
Выше уже говорилось, что простые вещества (или химические соединения), вступающие в химические реакции друг с другом, а также продукты реакций находятся в строго определенных количественных соотношениях. Следствием этого факта было введение в научный и практический обиход понятия эквивалент. Эквивалентом химического элемента (или молем эквивалентов) называется такое его количество, которое может заместить или присоединить к себе в химических, реакциях 1 моль атомов водорода или любого другого химического элемента, эквивалент которого известен. В соединениях 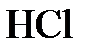 ,
,  ,
, 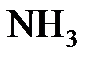 ,
, 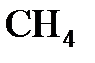 эквиваленты хлора, серы, азота и углерода равны 1 молю, 1/2 моля, 1/3 моля и 1/4 моля, соответственно. Эквивалент (или моль эквивалентов) сложного вещества - это такое его количество, которое взаимодействует без остатка с одним эквивалентом атомов водорода или с одним эквивалентом любого другого вещества.
эквиваленты хлора, серы, азота и углерода равны 1 молю, 1/2 моля, 1/3 моля и 1/4 моля, соответственно. Эквивалент (или моль эквивалентов) сложного вещества - это такое его количество, которое взаимодействует без остатка с одним эквивалентом атомов водорода или с одним эквивалентом любого другого вещества.
Масса одного эквивалента (или моля эквивалентов) химического элемента или вещества называется их эквивалентной массой (или молярной массой эквивалентом). Единицей измерения эквивалентной массы служит г/моль. Эквивалентная масса химического элемента  равна отношению мольной массы атомов
равна отношению мольной массы атомов  к его валентности В:
к его валентности В:
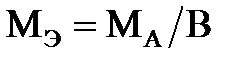 .
.
Так, эквивалентные массы хлора, серы, азота и углерода в приведенных выше соединениях равны 34,45 г/моль, (32/2=16) г/моль, (14/3=4,67) г/моль и (12/4=3) г/моль.
Способ определения эквивалентной массы сложных соединений зависит от их класса. Так, эквивалентная масса  кислоты равна ее мольной массе
кислоты равна ее мольной массе 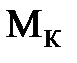 , деленной на основность О (число ионов водорода Н+, которое кислота отдает в реакции с основанием; основность
, деленной на основность О (число ионов водорода Н+, которое кислота отдает в реакции с основанием; основность 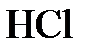 равна 1,
равна 1, 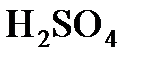 - 2,
- 2,  - 3):
- 3):
 .
.
Эквивалентная масса 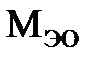 основания равна его мольной массе
основания равна его мольной массе 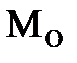 , отнесенной к валентности металла
, отнесенной к валентности металла  :
:
 .
.
И наконец, эквивалентная масса 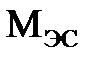 соли определяется как отношение ее мольной массы
соли определяется как отношение ее мольной массы  к произведению валентности металла
к произведению валентности металла  на число k его атомов в молекуле:
на число k его атомов в молекуле:
 .
.
Многие элементы, соединяясь друг с другом, могут образовывать по несколько соединений (например, СО и  ). Отсюда следует, что эквивалент химического элемента и его эквивалентная масса могут различаться в зависимости от того, какое соединение было взято для их определения. Так, в случае приведенных выше моно- и диоксида углерода эквивалентные массы углерода равны, соответственно, (12/2 = 6) г/моль и (12/4 = 3) г/моль, поскольку мольная масса атомов углерода равна 12 г/моль, а его валентность равна 2 в случае монооксида углерода и 4 - в случае диоксида.
). Отсюда следует, что эквивалент химического элемента и его эквивалентная масса могут различаться в зависимости от того, какое соединение было взято для их определения. Так, в случае приведенных выше моно- и диоксида углерода эквивалентные массы углерода равны, соответственно, (12/2 = 6) г/моль и (12/4 = 3) г/моль, поскольку мольная масса атомов углерода равна 12 г/моль, а его валентность равна 2 в случае монооксида углерода и 4 - в случае диоксида.
Кроме понятия эквивалентной массы, широко пользуются также понятием эквивалентного объема, под которым понимают объем, который занимает 1 эквивалент рассматриваемого газообразного вещества. Единицей измерения эквивалентного объема является л/моль. Поскольку 1 эквивалент водорода (атомарного) составляет половину 1 моля молекулярного водорода, становится понятно, что эквивалентный объем водорода при нормальных условиях равен половине мольного объема, т.е. 11.,2 л/моль. Соответственно, эквивалентный объем кислорода равен 5,6 л/моль, так как эквивалент кислорода равен 1/4 моля, т.е. в 2 раза меньше эквивалента водорода.
Изучение количественных закономерностей химических реакций привело к установлению закона эквивалентов: Массы  и
и 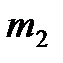 (или объемы
(или объемы 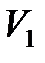 и
и  ) реагирующих друг с другом веществ пропорциональны их эквивалентным массам
) реагирующих друг с другом веществ пропорциональны их эквивалентным массам  и
и 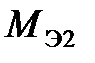 (объемам
(объемам  и
и  ):
):
 .
.
Из этого уравнения легко получается соотношение:
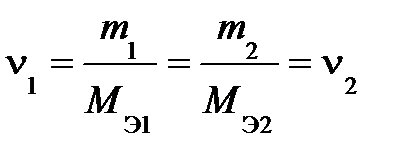 ,
,
где 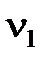 и
и 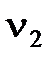 - количества эквивалентов реагентов. Как видим, количества эквивалентов реагирующих без остатка веществ равны между собой.
- количества эквивалентов реагентов. Как видим, количества эквивалентов реагирующих без остатка веществ равны между собой.
Рассмотрим для примера решение задач, в которых встречаются понятия, о которых только что шла речь.
Пример 1. Чему равна эквивалентная масса металла, если при взаимодействии 3 г его оксида с серной кислотой образовалось 9 г сульфата?
Решение. Составим уравнение реакции и - для наглядности - проставим под формулами оксида и сульфата их массы:

Зг 9г
Эквивалентная масса металла равна отношению его мольной массы  к валентности. Записав формулу оксида в виде
к валентности. Записав формулу оксида в виде 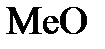 , мы тем самым определили, что валентность металла равна 2. Нам остается найти мольную массу металла. Для этого составим пропорцию:
, мы тем самым определили, что валентность металла равна 2. Нам остается найти мольную массу металла. Для этого составим пропорцию:
3 г оксида так относятся к 9 г сульфата, как
мольная масса оксида относится к мольной массе
( + 16) г/моль (
+ 16) г/моль ( +96) г/моль сульфата
+96) г/моль сульфата
Из этой пропорции получаем следующее равенство;
( + 16)´9 = (
+ 16)´9 = ( + 96)´3, откуда находим
+ 96)´3, откуда находим  24 г/моль.
24 г/моль.
Деля эту величину на найденную валентность, находим, что эквивалентная масса металла 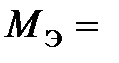 12 г/моль.
12 г/моль.
Ответ:  12 г/моль.
12 г/моль.
Примечание: Если бы мы записали формулу оксида в виде 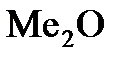 , то формула сульфата должна была бы быть записана в виде
, то формула сульфата должна была бы быть записана в виде 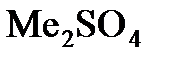 , что означало бы, что валентность металла равна 1. Проделав аналогичные математические выкладки, мы получили бы, что
, что означало бы, что валентность металла равна 1. Проделав аналогичные математические выкладки, мы получили бы, что 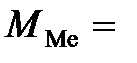 12 г/моль, а следовательно,
12 г/моль, а следовательно,  12 г/моль, как и в первом случае.
12 г/моль, как и в первом случае.
Пример 2. При взаимодействии с водой некоторого количества металла с эквивалентной массой, равной 19,55 г/моль, выделилось 3 л водорода. Определить массу металла.
Решение. Поскольку эквивалентный объем водорода известен (11,2 л/моль), составим пропорцию:
19,55 г/моль металла эквивалентны 11,2 л/моль водорода,
а х г металла эквивалентны 3 л водорода,
откуда 
Ответ: Масса металла равна 5,24 г.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 16882; Нарушение авторских прав?; Мы поможем в написании вашей работы!