
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Люминометрия и флуориметрия
|
|
|
|
Излучение (испускание) света молекулами – люминесценция – может происходить при передаче энергии им в различных процессах:
- воздействие потоком электронов (катодными лучами) – катодолюминесценция;
- тепловой нагрев – термолюминесценция;
- химические реакции – хемилюминесценция;
- воздействие электрическим током – электролюминесценция;
- ультразвуковое воздействие – сонолюминесценция;
- воздействие механическим трением – триболюминесценция;
- облучение ионизирующей радиацией – радиолюминесценция;
- облучение ультрафиолетовым и видимым светом – фотолюминесценция или флуоресценция.
В биомедицинских аналитических исследованиях, в основном, используют флуоресценцию и хемилюминисценцию.
Как уже отмечалось, в основе явления люминесценции лежат процессы поглощения энергии с последующим излучением фотонов. Механизм проявления эффекта люминесценции показан на рисунке.
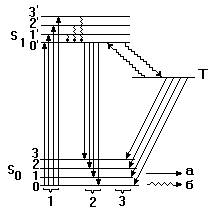
Схема энергетических уровней внутримолекулярных переходов:
1 - абсорбция; 2 - флуоресценция; 3 - фосфоресценция;
а - излучательные переходы; б - безызлучательные переходы.
Молекула, находившаяся в основном состоянии S0, в результате поглощения энергии переходит в состояние возбуждения S 1 с уровнями колебаний 0', 1' и т. д. Возбужденная молекула через 10-7–10-8 с возвращается в основное состояние, испуская флуоресцентное излучение. Так как чаще всего обратный переход происходит с самого низкого уровня колебаний в возбужденном состоянии на самый высокий уровень колебаний основного состояния, длина волны флуоресцентного излучения больше, чем возбуждающего излучения (правило Стокса).

За счет рассеяния энергии без излучения возможен переход из возбужденного состояния S 1 в метастабильное состояние Т, которое имеет продолжительность жизни от 10-3 до нескольких секунд. Излучательный переход из метастабильного состояния называют фосфоресценцией. Она находится в области еще более длинных волн, чем флуоресценция, и продолжается относительно долго после прекращения воздействия.
Явление флуоресценции получило свое название от природного минерала – флюорита CaF2, у которого оно впервые наблюдалось. Веществами, способными к свечению – флуорофорами – являются такие биологические соединения как триптофан, тирозин, фенилаланин, нуклеотиды (НАДН, НАДФ-Н), флавины, порфирины, хлорофиллы, каротиноиды, некоторые витамины, окисленные липиды, белки и другие. В качестве меток при проведении флуофесцентного и люминисцентного анализа часто используются флуорофоры и люминофоры, примеры которых представлены на рисунке:
Флуоресцентные метки (флуорофоры) широко используются в биохимии, биотехнологии, клеточной биологии и биологии развития в качестве маркеров экспрессии генов и локализации белков в различных биологических системах, а также их взаимодействий с окружающей средой. Для проведения исследования флуорофор прикрепляется к изучаемому белку.
Схемы наблюдения флуоресценции:
Для фотометрических исследований флуоресценции применяют специализированные фотометры – флуориметры, у которых выходная щель из кюветы смонтирована под углом к проходящему свету. Часто флуориметры объединены в один прибор с фотометрами, так как блок облучения кюветы и система электронной регистрации у них одинаковые.
1 – лампа; 2 – светофильтр; 3 – кювета с раствором исследуемого вещества; 4 – приемник излучения.
а – приемник принимает только флуоресцентное излучение. Такое расположение используется во многих фотометрах.
б – такая схема применяется только для сильно флуоресцирующих растворов.
В люминометрах характерной особенностью является отсутствие источника света, свечение образца индуцируется химической реакцией (хемилюминометры) или любым другим способом передачи энергии веществу.
В клинической химии достаточно часто встает вопрос о выборе технологии для определения той или иной группы аналитов. Например, определение гормонов можно проводить методами фотометрирования, в том числе турбидиметрией и нефелометрией или ИФА-анализом, можно воспользоваться технологиями, основанными на использовании флюоресцентной или люминесцентной метки. Основным недостатком фотометрических методов является относительно узкий линейный диапазон измерения результатов. Даже лучшие фотометры позволяют регистрировать изменения аналитов (гормонов) не более, чем в пределах 4 десятичных порядков.
Флюоресцентные и люминесцентные технологии увеличивают линейный диапазон до 6-8 десятичных порядков, то есть позволяют работать без разведения.
Оптическая схема флуориметра схожа со схемой нефелометра. Чаще всего излучение, равномерно направленное во все стороны, измеряется в направлении, составляющем 90° с направлением исходного излучения.
Для спектрального разделения длинноволнового люминесцентного излучения и рассеянного, более коротковолнового, излучения между пробой и приемником находится вторичный фильтр или монохроматор.
В качестве источника излучения обычно используются ртутные дуговые лампы. Они выдают линейчатый спектр с максимумами на 365, 405, 436 и 546 нм. Могут применяться также ксеноновые и газоразрядные водородные лампы. В качестве детекторов обычно используются фотоумножители.
Фотопоток флуоресценции, испускаемый во всех направлениях (при малых концентрациях, когда наблюдается равномерное свечение образца), описывается выражением
ФФ = Ф0(1 – Т) n и/ n п = Ф0(1 – 10–e СL ) n и/ n п,
где n и и n п – число излученных и число поглощенных квантов. При малых значениях концентрации данное выражение может быть преобразовано к виду[1]
ФФ = Ф0ln(10)e СLn и/ n п = KC,
где К = Ф0ln(10)e Ln и/ n п – постоянный коэффициент.
Таким образом, при малых концентрациях определяемого компонента в анализируемой пробе (наиболее часто встречающиеся случаи использования флуоресцентного анализа) поток флуоресценции пропорционален концентрации определяемого компонента в анализируемой пробе.
Одним из преимуществ флуориметрии является более высокая чувствительность, которая может на четыре порядка превышать чувствительность фотометрических методов. Это происходит потому, что в фотометрических методах для определения неизвестной концентрации анализируемого вещества в образце измеряется разность в поглощении между раствором, содержащим нулевую концентрацию анализируемого вещества, и анализируемым образцом. В случае сильно разбавленных образцов небольшие отклонения в процессе измерения могут привести к большим относительным ошибкам в результатах. В случае флуориметрии осуществляется прямое измерение флуоресценции образца.
Особым преимуществом флуориметрии является очень высокая специфичность определения. В случае фотометрического измерения, в рабочей полосе частот помимо поглощения анализируемого вещества может присутствовать поглощение и других веществ. При флуориметрии же лишь небольшое число веществ обладает способностью к флуоресценции. Таким образом, многие вещества, мешающие друг другу при одновременном присутствии в фотометрическом измерении, уже не могут помешать друг другу при измерении флуоресценции. Кроме того, вещества, имеющие сходные спектры возбуждения, могут иметь различные спектры испускания и наоборот.
Совокупность этих свойств обеспечивает возможность флуориметрического определения пикограммовых количеств анализируемых веществ.
Принципиальным недостатком флуориметрических методов является зависимость результатов измерений от температуры и рН в образце.
Поляризация флюоресценции. При прохождении через кристаллическую решетку (поляризатор) волны света ориентируются в одной плоскости, такой свет называется поляризованным. В силу броуновского движения молекулы в растворе не только непрерывно перемешиваются, перемещаясь в пространстве, но и хаотически вращаются. Время, за которое молекулы успевают равномерно распределиться в пространстве, называется временем релаксации, соответственно говорят и о времени вращательной релаксации, как о том промежутке времени, который необходим для того, чтобы первоначально одинаково ориентированные молекулы оказались равномерно повернутыми в разные стороны. Для больших молекул этот промежуток времени длиннее, чем для маленьких. Если время вращательной релаксации велико по сравнению с временем между поглощением кванта света и его эмиссией (затухания флюоресценции), то молекула флюорофора не успевает повернуться и свет эмиссии будет поляризован в той же плоскости, что и возбуждающий свет. Если же молекула небольшого размера, то она вращается быстро и за время между поглощением света и его эмиссией успевает повернуться. Соответственно свет флюоресценции не будет поляризован в той же плоскости, что свет возбуждения, а будет деполяризованным. Таким способом можно оценить размеры молекулы. Устройство прибора для анализа поляризации флюоресценции представлено на рисунке для сравнения приведена также схема флюориметра:


| Схема устройства флюориметра: 1 – источник, 2, 4 – монохроматоры, 3 – кювета, 5 – детектор, 6 - измеритель | Схема устройства анализатора поляризации флуоресценции: 1 – источник, 2, 5 – монохроматоры, 3,6 – поляризатор и анализатор, 4 – кювета, 7 – детектор, 8 - измеритель |
Этот эффект используется при проведении гомогенных иммуноисследований. Пока меченый флюорофором антиген не образовал комплекса с антителом, его молекула невелика, вращается быстро и, если ее возбудить поляризованным светом, то флюоресценция будет неполяризованной. Однако, если реакция антиген-антитело уже прошла, образовались высокомолекулярные комплексы, флюоресцирующая группировка становится неповоротливой, и подобно большому флюорофору излучает поляризованный свет.
Поляризация флюоресценции используется для определения лекарств, наркотиков и других малых молекул иммунохимическим методом. Методика основана на конкуренции между исследуемым аналитом и меченым флюорофором эталоном за ограниченное количество связывающих мест на антителе. Если исследуемого аналита в пробе мало, образуется много меченого флюорофором неповоротливого комплекса антиген-антитело и степень деполяризации мала. Наоборот, если концентрация аналита в пробе велика, образуется мало меченого флюорофором комплекса антиген-антитело и деполяризация будет значительна. Преимущество этого метода в том, что связанный флюорофор не надо отделять от свободного, отпадает необходимость в многократных отмываниях и т.д. поэтому методику называют гомогенной иммунопробой.
Флюоресценция с разрешением во времени. Чувствительность флюоресцентных методов в значительной степени зависит от помех, вызванных тем, что свет возбуждения примешивается к свету эмиссии, а также неспецифической флюоресценцией исследуемого биологического объекта. Если сдвиг Стокса (т.е. различие в длинах волн света возбуждения и эмиссии) велик, помехи меньше как потому, что удается «уйти» от света возбуждения флюоресценции, так и потому что у неспецифической флюоресценции сдвиг Стокса мал. Помехи можно уменьшить и используя временнУю задержку (разрешение во времени) – возбуждать флюоресценцию короткими импульсами света, а измерять ее через некоторое время, когда возбуждающий импульс уже угас. Разумеется, технически это осуществимо только при условии, что время флюоресценции флюорофора велико. На этом основана ФРВ - флюоресценции с разрешением во времени – по-английски time-resolved fluorometry (TRF).
Используя ФРВ, удается создать флюоресцентные метки с чувствительностью и избирательностью намного более высокими, чем у органических красителей, например, флюоресцеина, эти метки по чувствительности приближаются к радиоактивным. В качестве флюорофоров используются лантаниды – редкоземельные элементы (№ № 58-71 по таблице Менделеева): самарий (Sm), европий (Eu), тербий (Tb) и др. Для них сдвиг Стокса измеряется сотнями нанометров, а время флюоресценции сотнями микросекунд, что во много раз больше, чем у обычных флюорофоров.
Измеряя флюоресценцию на разных длинах волн и через разные промежутки времени после освещения импульсом возбуждающего света, можно одновременно количественно определять несколько флюорофоров этой группы. Это позволяет использовать двойные метки – например, одновременно пометить и измерять концентрации и антигена и антитела, что значительно повышает точность определения.
Хемилюминесценция. Свечение молекул, перешедших в возбужденное состояние в результате химической реакции, называется хемилюминесценцией. Чаще всего ее вызывают, окисляя определенные органические вещества перекисью водорода, гипохлоридом, молекулярным кислородом.
Специальная форма хемилюминесценции биологического материала, когда каталитический белок, например, люцифераза, повышает эффективность люминесцентной реакции, называется биолюминесценцией. Чувствительность определения с помощью биолюминесценции выше, чем при прямом флюоресцентном исследовании, и сравнима с чувствительностью иммунных проб. Для измерения люминесценции используются люминометры.
Принцип хемилюминесцентной детекции реализуется в вариантах хемилюминесцентных методик и хемилюминесцентной детекции ферментных меток в иммунохимических исследованиях. Основными хемилюминесцентными метками служат сульфонамиды и эфиры акридина, инициаторами их свечения выступает смесь перекиси водорода и гидроокиси натрия. Вспышки длительностью до 5 сек регистрируются, предел детекции эфира акридина 0,5 аттомолей (5·10-18).
Хемилюминесцентная детекция ферментных методик чувствительнее и удобнее колориметрической или флюоресцентной детекции.
Еще одним вариантом является электрохемилюминесценция, представляющая собой процесс возникновения свечения, при котором высоко реактивные соединения, способные испускать свет, образуются из стабильных предшественников на поверхности электрода, к которому приложен положительный потенциал. Для этого могут использоваться соединения рутения, осмия, рения и других элементов. В электрохемилюминесцентном методе, который реализуется на приборах Elecsys («Roche Diagnostics»), в качестве метки применяется комплекс рутений (II)-трис (бипиредил)32+ NHS эфир, который способен сопрягаться с аминогруппами белков, гаптенов и нуклеиновых кислот. Бипиридиловые лиганды могут легко преобразовываться в форму активных хемилюминесцентных соединений.
Моноклональные антитела, меченые рутением, сопрягаются с исследуемым антигеном, который захвачен другими моноклональными антителами, связанными с биотином и за счет стрептавидина прочно связанными с магнитными шариками диаметром 2,8 мкм.

Схема связывания исследуемого антигена. 1. Магнитные микрочастицы, покрытые стрептавидином. 2. Моноклональные антитела, связанные с биотипом. 3. Исследуемый антиген. 4. Моноклональные антитела, меченые рутением.
Под влиянием магнита магнитные частицы с иммунным комплексом, меченым рутением, привлекаются в зону контакта с рабочим электродом, в результате чего развивается электрохемилюминесцентная реакция, интенсивность которой регистрируется фотоумножителем.

Схема измерительной части прибора
Последовательность происходящих на поверхности положительного электрода процессов такова: окисляющийся под влиянием заряда электрода трипропиламин (ТПА) высвобождает протон и становится нестабильным радикалом, который, в свою очередь, отдавая электрон образовавшемуся при контакте с электродом трехвалентному рутениевому бипиридилу, переводит его в возбужденную форму, способную, испустив фотон света с длиной волны 620 нм, возвратиться в исходное стабильное состояние.

Принцип элктрохемилюминесцентной реакции.
Как видно из этого описания, имеет место хемилюминесцентная реакция, инициируемая электрическим зарядом электрода, что и дало название этому методу.
В таблице приведены технические характеристики некоторых флюорометров и люминометров отечественного и зарубежного производства.
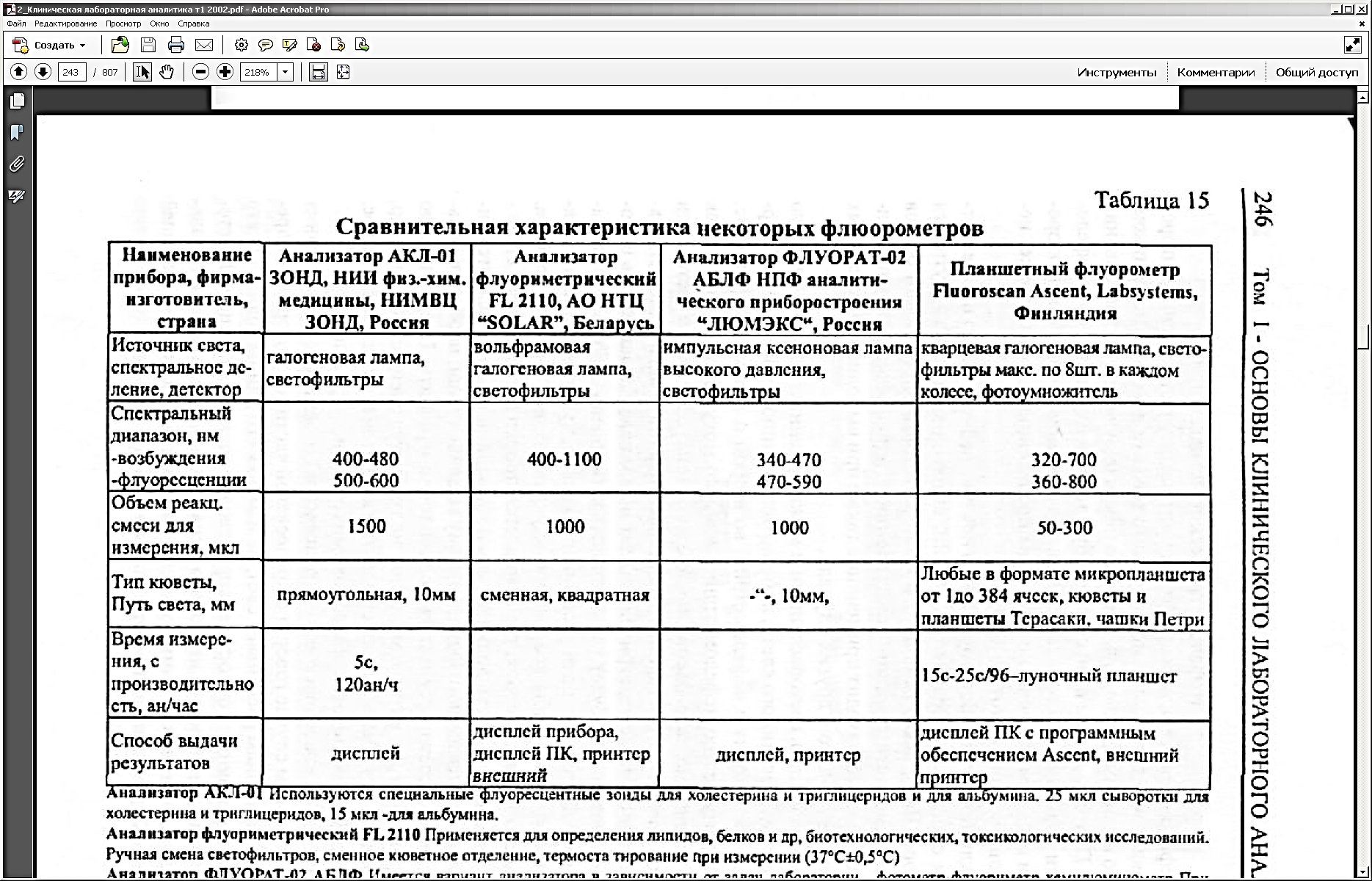


| 
|
| анализатор флуориметрический FL 2110 (Беларусь) | анализатор ФЛУОРАТ-02 (Россия) |
| WALLAC 1420 MULTILABEL COUNTER (VICTOR-2) (Финляндия) |

|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 4552; Нарушение авторских прав?; Мы поможем в написании вашей работы!