
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Задача 1. Смесь кислорода и азота при температуре t=270С находится под давлением Р=2,3·102 Па
|
|
|
|
Задача 1. Смесь кислорода и азота при температуре t=270С находится под давлением Р =2,3·102 Па. Масса кислорода составляет 75% от общей массы смеси. Определите концентрацию молекул каждого из газов.
| Дано: Т =300 К; Р =2,3·102 Па; m1 =0,75 m; М1 =0,032 кг/моль; М2 =0,028 кг/моль. | Решение:
Смесь газов принимаем за идеальный газ, описываемый уравнением Менделеева– Клапейрона:
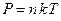 , (1)
где , (1)
где  - (2) концентрация смеси газов; - (2) концентрация смеси газов; 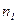 – концентрация молекул кислорода, – концентрация молекул кислорода, 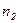 – концентрация молекул
азота; – концентрация молекул
азота; 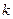 – постоянная Больцмана. – постоянная Больцмана.
|
| n1 -? n2 -? |
Из выражений (1) и (2) имеем:
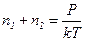 .
.  (3)
(3)
Выразим концентрацию n1 через концентрацию n2.
По условию задачи масса кислорода:
m1 = 0,75 m, (4)
где m – масса смеси.
Массу кислорода можно выразить также через концентрацию n1 и объем газа:
m1 = 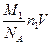 , (5)
, (5)
где М1 – молярная масса кислорода; NA – число Авогадро; V – объем газа.
Приравняв правые части выражений (4) и (5), получим:
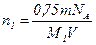 . (6)
. (6)
Масса азота m2=0,25m, или иначе 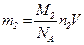 . Приравняв значения m2 из последних двух формул, найдем:
. Приравняв значения m2 из последних двух формул, найдем:
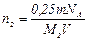 . (7)
. (7)
Из выражений (6) и (7) имеем:
 . (8)
. (8)
Подставив в формулу (3) значение n2 из последнего выражения, получим n1 =  . После подстановки значений и вычисления n1 = 0,40·1023 1/м3, n2 = 0,15·1023 (1/м3).
. После подстановки значений и вычисления n1 = 0,40·1023 1/м3, n2 = 0,15·1023 (1/м3).
Ответ: n1 = 0,40·1023 1/м3, n2 = 0,15·1023 (1/м3).
Задача 2. В закрытом сосуде объемом V =1 м3 находится m1 =1кг азота и m2 =1,5 кг воды. Определите давление в сосуде при температуре t=6000С, зная, что при этой температуре вся вода превратится в пар.
| Дано: V=1 м3; m1=1 кг; m2=1,5 кг; Т=873 К; M1=0,028 кг/моль; M2=0,018 кг/моль. | Решение:
По закону Дальтона давление в сосуде после превращения воды в пар:
Р=Р1+Р2, (1)
где Р1 - давление азота, Р2 – давление водяного пара. Состояние азота в сосуде определяется уравнением Менделеева - Клапейрона:
 (2)
где M1 – молярная масса азота, R – универсальная газовая постоянная. Аналогично для водяного пара: (2)
где M1 – молярная масса азота, R – универсальная газовая постоянная. Аналогично для водяного пара:
 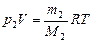 , (3)
где M2 – молярная масса водяного пара. , (3)
где M2 – молярная масса водяного пара.
|
| Р -? |
Из уравнений (2) и (3) имеем:  ,
, 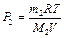 . После подстановки давлений Р1 и Р2 в выражение (1) имеем
. После подстановки давлений Р1 и Р2 в выражение (1) имеем  Используя числовые значения, получим: Р = 8,62·105 Па.
Используя числовые значения, получим: Р = 8,62·105 Па.
Ответ: Р = 8,62·105 Па.
Задача 3. Определите число молекул воздуха в аудитории объемом V =180 м3 при температуре t=220С и давлении Р =0,98·105 Па. Какова концентрация молекул воздуха при этих условиях?
| Дано: V =180 м3; Т =295 К; Р =0,98· 105 Па; | Решение:
Число молей воздуха в аудитории:
 (1)
где – NA - число Авогадро, m – масса воздуха в аудитории, М – молярная масса воздуха.
Из выражения (1):
N = (1)
где – NA - число Авогадро, m – масса воздуха в аудитории, М – молярная масса воздуха.
Из выражения (1):
N = 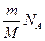 . (2) . (2)
|
| N -?, n -? |
Число молей воздуха в аудитории можно выразить, используя уравнение Клапейрона-Менделеева  откуда
откуда  После подстановки
После подстановки 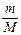 из последней формулы в выражение (2) получим:
из последней формулы в выражение (2) получим:
 . (3)
. (3)
Используя числовые значения, определим N = 0,43·1028. Проверим единицы измерения правой части выражения (3) 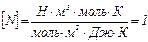 . Концентрацию (число молекул в единице объема) определим по формуле:
. Концентрацию (число молекул в единице объема) определим по формуле:
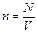 . После подстановки: n =0,24·1026
. После подстановки: n =0,24·1026 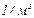 .
.
Ответ: N = 0,43·1028, n =0,24·1026 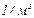 .
.
Задача 4. Определите среднюю квадратичную скорость молекул некоторого газа, плотность которого при давлении Р =1,1·105 Па равна ρ =0,024 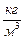 . Какова масса одного моля этого газа, если значение плотности дано для температуры 270 С?
. Какова масса одного моля этого газа, если значение плотности дано для температуры 270 С?
Дано:
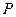 = 1,1·10 5 Па; = 1,1·10 5 Па;
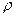 = 0,024 = 0,024  ; ;
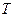 = 300 К. = 300 К.
| Решение:
Для определения средней квадратичной скорости движения молекул используем основное уравнение молекулярно-кинетической теории в таком виде:
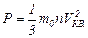 , (1)
где m0 – масса одной молекулы газа, n – концентрация молекул.
Так как m0n = ρ, то уравнение (1) можно записать , (1)
где m0 – масса одной молекулы газа, n – концентрация молекул.
Так как m0n = ρ, то уравнение (1) можно записать
|
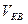 -? -? 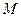 -? -?
|
в таком виде: 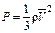 , откуда
, откуда 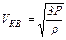 ,после подстановки числовых значений и вычисления получим:
,после подстановки числовых значений и вычисления получим:

 .
.
Для определения массы одного моля газа используем уравнение Клапейрона-Менделеева -  откуда
откуда 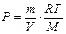 . Так как
. Так как  , то
, то  , или
, или 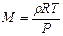 . После подстановки числовых значений и вычисления:
. После подстановки числовых значений и вычисления:
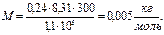
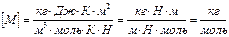 .
.
Ответ: 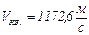 ,
, 
Контрольные задания
4.1.Определите число молей и концентрацию молекул газа, объем которого V = 2,4·10-4 м3, температура t = 270 С и давление Р =0,5·105Па.
4.2. В сосуде находится смесь m1 = 0,02 кг углекислого газа и m2 = 0,015 кг кислорода. Определите плотность этой смеси при температуре t = 270 С и давлении Р = 1,5·105 Па.
4.3.В закрытом сосуде объемом V =0,5 м3 находится m1 =0,45 кг воды и m2 = 0,8 кг азота. Определите давление в сосуде при температуре t = 5000 С, полагая, что при этой температуре вся вода превращается в пар.
4.4. В закрытом сосуде находится m1 =0,015 кг азота и m2 =0,018кг кислорода при температуре t=270 С и давлении Р =5·105 Па. Определите объем и молярную массу смеси газов.
4.5.При каком давлении следует наполнить воздухом баллон объемом V1 = 2·10-3 м3, чтобы при соединении его с баллоном объемом V2 = 4·10-3 м3, содержащим воздух при давлении Р2 = 0,1 МПа, установилось общее давление Р = 0,25 МПа?
4.6. В баллоне объемом V = 6·10-2 м3 находится кислород при температуре t = 270С. Определите массу израсходованного кислорода, если давление в баллоне уменьшилось на ΔP = 100 кПа. Процесс считать изотермическим.
4.7.В баллоне объемом V = 0,01 м3 находится гелий под давлением Р = 106 Па и при температуре t = 270С. Определите давление в баллоне после того, когда из баллона выпустили m = 0,01 кг гелия, а температура понизилась до 170С.
4.8. В сосуде находится смесь m1=0,06 кг углекислого газа и m2=0,010 кг азота. Определите плотность этой смеси при t=37о С и давлении P=1,5·105 Па.
4.9.В сосуде емкостью V = 0,02 м3 содержится смесь водорода и азота при температуре t = 270С и давлении Р = 1,2·106 Па. Масса смеси m = 0,145 кг. Определите массу водорода и азота в сосуде.
4.10. Определите плотность углекислого газа, находящегося в сосуде под давлением Р = 2·105 Па и имеющего температуру t = 70C.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 10181; Нарушение авторских прав?; Мы поможем в написании вашей работы!