
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретичні відомості
|
|
|
|
Поверхневі явища – це процеси, які відбуваються на межі поділу фаз гетерогенних систем.
За агрегатним станом контактуючих фаз поверхні поділу класифікують на:
· рухомі межі поділу: рідина – газ (Р – Г), рідина – рідина (Р–Р);
· нерухомі межі поділу: тверде тіло – газ (Т – Г), тверде тіло – рідина (Т – Р), тверде тіло – тверде тіло (Т – Т).
Виникнення поверхневих явищ зумовлено силами міжмолекулярної взаємодії, які особливо яскраво виявляються на міжфазних межах поділу.
Збільшення площі поверхні поділу фаз зв'язане з переходом молекул із глибини фази на поверхню, для чого необхідно виконати роботу проти сил внутрішнього тиску. Ця робота dW в оборотних ізотермічних умовах пропорційна площі поверхні dS, яка утворюється:
– dW = σ∙dS,
де σ – коефіцієнт пропорційності, який називається поверхневим натягом. Фізичний зміст σ полягає в тому, що він чисельно дорівнює роботі утворення одиниці поверхні. Робота, витрачена на збільшення площі поверхні, перетворюється у потенційну енергію молекул поверхневого шару. Звідси випливає, що молекули поверхневого шару набувають надлишкового запасу енергії порівняно з молекулами усередині фази, який називається поверхневою енергією. В залежності від умов (р = const або V = const) збільшується енергія Гіббса (G або енергія Гельмгольца F). Тоді фізичний зміст поверхневого натягу може бути розшифрований із врахуванням
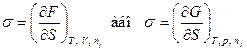
як питома надлишкова поверхнева енергія. Розмірність поверхневого натягу [σ] = Дж/м2 = Н/м.
Величину поверхневого натягу можна визначити достатньо простими методами: капілярного підняття рідини, максимального тиску бульбашок повітря (метод Ребіндера), сталагмометричним, відриву кільця (метод Дью Нуї), втягування пластинки (метод Вільгельмі) тощо.
Кожна чиста рідина за сталої температури має певну величину поверхневого натягу, яка залежить від її природи. Вона тим більша, чим більша полярність молекул рідини, і залежить від здатності молекул утворювати водневі зв'язки.
Поверхневий натяг багатьох рідин лінійно зменшується з підвищенням температури, оскільки середня відстань між молекулами збільшується, внаслідок чого послаблюються сили взаємодії між молекулами, що призводить до зменшення поверхневого натягу. Виходячи з цієї закономірності, Д. І. Менделєєв встановив, що за певної критичної температури (температури кипіння) величина поверхневого натягу дорівнює нулю.
Залежність поверхневого натягу рідин від температури має вигляд:
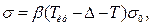
де β – коефіцієнт пропорційності; ∆ – константа; Ткр і Т – відповідно критична і температура досліду; σ0 і σТ – відповідно поверхневий натяг за початкової та кінцевої температури.
Міжфазний натяг на межі двох незмішуваних рідин можна розрахувати за правилом Антонова:
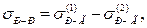
де  – міжфазний натяг на межі поділу між насиченими розчинами першої рідини у другій та другої у першій;
– міжфазний натяг на межі поділу між насиченими розчинами першої рідини у другій та другої у першій;  – поверхневий натяг на межі з газом (повітрям) насиченого розчину рідини 2 у рідині 1;
– поверхневий натяг на межі з газом (повітрям) насиченого розчину рідини 2 у рідині 1; 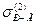 – поверхневий натяг на межі з газом (повітрям) насиченого розчину рідини 1 у рідині 2.
– поверхневий натяг на межі з газом (повітрям) насиченого розчину рідини 1 у рідині 2.
З термодинаміки випливає, що будь-яка гетерогенна система прагне зменшити до мінімуму поверхневу енергію Gs = σS (при р і Т = const). Це виражається або в самодовільному зменшенні міжфазної поверхні (при перекристалізації із насичених розчинів дрібні кристали самодовільно зростають; у дисперсних системах відбуваються процеси коагуляції, тобто змінюються форма та кривизна поверхні), або у зменшенні поверхневого натягу (процеси адсорбції тощо).
Отже, наявність у міжфазних шарів надлишкової вільної енергії призводить до різноманітних поверхневих явищ. Їх можна умовно розділити на дві групи. До першої групи відносять явища, зв'язані із зміною форми поверхні поділу (змочування, адгезія тощо). До другої групи відносять, наприклад, адсорбцію, пов'язану із зміною складу поверхневого шару.
Взаємне притягання частинок (молекул, атомів або йонів) у середині гомогенної частини системи – фази – називають когезією (зчепленням).
Для рідин та багатьох твердих тіл когезійні сили є нічим іншим, як силами міжмолекулярної (ван-дер-ваальсової) взаємодії. Вона відрізняється від хімічної взаємодії відсутністю специфічності та насиченості, невеликими енергіями, виявленням на значно більших відстанях. Розрив міжмолекулярних зв'язків призводить до формування поверхні, здатної утворювати ван-дер-ваальсові та водневі зв'язки з молекулами, які потрапляють на цю поверхню.
Когезія відображує міжмолекулярну взаємодію всередині фази, тому її можуть характеризувати такі параметри, як енергія кристалічної решітки, внутрішній тиск, температура кипіння та ін. Але найбільш застосовною кількісною характеристикою стала запропонована Гаркінсом робота когезії, яка визначається витратою енергії на оборотний ізотермічний розрив тіла по перерізу, рівному одиниці площі. Через те, що при розриві утворюються дві нові поверхні, площа яких складає дві одиниці, робота когезії дорівнює подвоєному значенню поверхневого натягу на межі з газом:
Wc = 2σ.
Wc називають ще когезійною міцністю, або міцністю на розрив (оборотний). Ця робота витрачається на подолання сил зчеплення між однорідними молекулами води (бензену) або іншої речовини.
Силу притягання між молекулами взаємно нерозчинних рідин або рідини і твердої поверхні, наприклад, скляної пластинки, називають адгезією. Робота, витрачена на подолання сил зчеплення між молекулами двох взаємно нерозчинних рідин на одиниці площі, називається роботою адгезії. Яка визначається за рівнянням Дюпре:
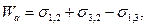
де σ1,2 – поверхневий натяг на межі вода-повітря; σ3,2 – поверхневий натяг на межі бензен-повітря; σ1,3 – поверхневий натяг на межі вода-бензен.
Адгезія може також спостерігатися між рідиною та твердим тілом або між двома твердими тілами.
Гаркінс запропонував використовувати роботу когезії та роботу адгезії як критерії явища розтікання. Припустимо, що на деяку поверхню (тверду або рідку), наприклад, на воду нанесли краплю рідини. Якщо сили притягання між молекулами рідини більші, ніж сили притягання між молекулами рідини і молекулами води, то рідина збереже форму краплі і розтікання не буде. Навпаки, якщо когезія рідини буде менша адгезії по відношенню до води, відбудеться її розтікання по поверхні води. Звідси випливає, що критерієм розтікання може служити різниця f = Wa – Wc, яку Гаркінс назвав коефіцієнтом розтікання. Він є зміною (із зворотним знаком) вільної поверхневої енергії одиниці поверхні, яка відбувається при розтіканні рідини. Якщо f > 0, то рідина буде розтікатися по поверхні, тому що цей процес супроводжується зменшенням вільної поверхневої енергії і відбувається самодовільно.
Отже, при нанесенні краплини рідини на поверхню твердого тіла можна спостерігати два крайніх випадки: краплина приймає форму, близьку до сферичної (краплина води на поверхні парафіну), або вона розтікається по поверхні твердого тіла (краплина води на поверхні хімічно чистого скла) (рис. 1.1.). Можливі також перехідні випадки в залежності від співвідношення інтенсивності міжмолекулярної взаємодії, з одного боку, між молекулами рідини, і з другого – між молекулами рідини та твердого тіла.
σТ–Г > σТ–Р σТ–Г < σТ–Р
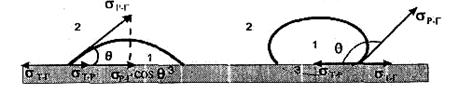
Рис.1.1. Змочування і крайовий кут: 1 – рідина, 2 – газ, 3 – тверде тіло
Сукупність явищ, які відбуваються на межі трьох фаз, називають змочуванням. Мірою змочування є рівноважний кут, який нанесена краплина утворює з твердою поверхнею. Його визначають як кут між поверхнею твердого тіла і дотичною в точці дотику трьох фаз (рис. 1.1.) і називають крайовим кутом або кутом змочування (q). Крайовий кут завжди вимірюють з боку рідини, він може змінюватися в межах від 0 до 180°.
При утворенні крайового кута q всі три сили повинні урівноважувати одна одну. Умову рівноваги можна записати через рівняння Юнга:
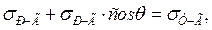
або
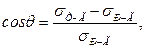
де σР-Г, σТ-Г, σТ-Р – поверхневі натяги відповідно на межах рідина–газ, тверде тіло–газ, тверде тіло–рідина.
Величину cos q, яка характеризує здатність рідини змочувати поверхню, називають змочуванням і позначають В. Таким чином, повне незмочування відповідає умові: q = 180°, В = cos q = –1; повне змочування: q = 0°, В = cos 0 = 1. Наприклад, вода на поверхні різних твердих тіл в атмосфері повітря утворює такі крайові кути: q = 0° (кварц), q = 69° (тальк), q = 106° (парафін), q = 108° (фторопласт).
Дана тверда поверхня тим краще змочується рідиною, чим менші сили зчеплення між утворюючими її молекулами (когезія) і чим більші сили прилипання між молекулами рідини і твердого тіла (адгезія). Тому критерій змочування можна виразити через роботу адгезії Wa і роботу когезії Wc. Для системи тверде тіло–рідина можна записати
Wa = σР-Г – σТ-Г – σТ-Р.
Приймаючи до уваги співвідношення cosq приведене вище, маємо після складання виразів рівняння Дюпре–Юнга:

Воно дозволяє розрахувати роботу адгезії за експериментально виміряними значеннями σР-Г і cos q. Звідси видно, що чим більша адгезія, тим більший cosq, тобто змочування.
Wс = 2 σР-Г, отже, останнє рівняння можна записати у вигляді:


Таким чином, чим більша різниця між роботами адгезії та когезії (тобто коефіцієнт розтікання f = Wa – Wc), тим краще рідина змочує поверхню.
Великий практичний інтерес має випадок змочування на межі зіткнення твердої фази з двома незмішуваними рідинами, які відрізняються за молекулярною природою (полярною, наприклад, водою, і неполярною, наприклад, вуглеводнем).
П. О. Ребіндер для таких випадків запропонував ввести поняття вибіркового змочування. Про рідину, яка краще змочує тверду поверхню, говорять, що вона виявляє вибіркове змочування. Якщо вода вибірково змочує тверду поверхню ( q < 90°, В > 0), то останню називають гідрофільною (олеофобною). Речовини з гідрофільними поверхнями: кварц, целюлоза, силікат, гіпс, скло та ін. Згідно з правилом зрівнювання полярностей, сформульованим П. О. Ребіндером, речовина С буде адсорбуватися на поверхні поділу фаз А і В, якщо орієнтація її молекул буде сприяти зниженню надлишку вільної поверхневої енергії. Спираючись на це правило, можна передбачити, що поверхнево-активна речовина повинна адсорбуватися на поверхні поділу тверде тіло–рідина тим більше, чим більша між ними різниця полярностей, або чим більший орієнтуючий вплив на молекули речовини, яка адсорбується.
Якщо ж тверде тіло краще змочується неполярним вуглеводнем, а для води q > 90° і В < 0, то його поверхня називається гідрофобною (олеофільною). Речовини з гідрофобними поверхнями: графіт, вугілля, тальк, сірка, парафін, сульфіди важких металів та ін.
Згідно із другим законом термодинаміки, змочування є самодовільним процесом, оскільки воно супроводжується зменшенням поверхневої енергії, отже при змочуванні повинно виділятися тепло. Теплота змочування може бути критерієм змочування в тих випадках, коли неможливо експериментально визначити q, наприклад, при змочуванні рідиною порошків.
Це має велике значення для медицини, технології ліків та інших галузей науки та виробництва. Знаходячи теплоти змочування поверхні полярним та неполярним розчинниками, можна оцінити її гідрофільність. Для визначення гідрофільності поверхонь порошкоподібних тіл П. О. Ребіндер запропонував використовувати відношення теплоти змочування її водою q1 до теплоти змочування бензеном (або гексаном) q2: β = q1/ q2. Для гідрофільної поверхні β > 1, для гідрофобної – β < 1.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1496; Нарушение авторских прав?; Мы поможем в написании вашей работы!