
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сорбційні процеси і їх класифікація
|
|
|
|
Якщо внести у водний розчин оцтової або іншої карбонової кислоти тверду речовину, наприклад, порошок активованого вугілля, то на поверхні поділу фаз, що утворилася, відбудеться накопичення молекул розчиненої речовини. Причому далі поверхневого шару це переміщення молекул не відбувається. Аналогічне явище буде спостерігатися при контакті вугілля з повітрям, в якому є фосген, хлор, або інші гази у стані, далекому від насичення.
Наведені приклади не вичерпують всіх явищ, які мають місце в гетерогенних системах і зв'язані із зміною концентрації компонентів. Усі подібні процеси Дж. Мак-Бен назвав сорбційними. Отже, сорбцією називають зміну концентрації одного або декількох компонентів у гетерогенній системі. Сорбентами називаються поглинаючі речовини, незалежно від їх агрегатного стану і ступеня дисперсності (наприклад, тверді сорбенти – активне вугілля, силікагель; рідкий сорбент – краплі емульсії; газоподібний сорбент – бульбашки піни).
Процеси, які завершуються в поверхневому шарі, можна розділити на адсорбцію та поверхневі хімічні реакції. Приклади адсорбції хлору із повітря та з розчину на вугіллі.
Процеси, які проходять не тільки на поверхні, але й у об'ємі твердого сорбенту, поділяють на абсорбцію, хемосорбцію і капілярну конденсацію. Прикладом абсорбції може служити поглинання водню платиною або нікелем. Хемосорбція спостерігається при поглинанні карбон (IV) оксиду кальцій оксидом, вона супроводжується збільшенням кількості фаз у системі, на відміну від поверхневих хімічних реакцій. Капілярна конденсація відбувається при контакті пористих сорбентів із парою, яка легко конденсується: води, спирту, бензолу та інших рідин.
Абсорбція спостерігається при поглинанні інертного газу усім об'ємом рідкої фази, а хемосорбція – при хімічній взаємодії, наприклад, при поглинанні аміаку краплями води або розчином хлоридної кислоти. На відміну від хемосорбції на твердих сорбентах, у такому випадку звичайно відсутні умови створення нової фази.
Адсорбцією називається процес самодовільної зміни концентрації компонента у поверхневому шарі, порівняно із об'ємом фази.
Зміні концентрації речовини у поверхневому шарі, яка проходить в результаті дії міжмолекулярних сил, буде перешкоджувати тепловий рух молекул, що намагається вирівняти концентрацію компонента в усіх частинах системи. Внаслідок дії цих протилежних факторів у системі через деякий час встановлюється адсорбційна рівновага, при якій концентрація речовини у поверхневому шарі буде більшою (позитивна адсорбція) або меншою (негативна адсорбція), порівняно з її концентрацією у об'ємі фази.
Речовину, на поверхні якої проходить адсорбція, називають адсорбентом. Речовину, концентрація якої змінюється у поверхневому шарі, називають адсорбтивом (іноді адсорбатом).
Кількість адсорбованої речовини визначають експериментально, знаходячи тиск або концентрацію адсорбтиву до і після адсорбції. Часто кількість речовини, яка адсорбована твердим тілом, визначають ваговим методом за зміною маси адсорбенту.
Адсорбцію прийнято виражати кількома способами:
1. Запропонованою Гіббсом величиною Г, яка дорівнює різниці між фактичною кількістю адсорбтиву в об'ємі поверхневого шару площею 1 м2 та кількістю його у такому ж об'ємі фази, при умові, що біля міжфазної межі концентрація адсорбтиву не змінюється.
2. Величиною А (або а), яка представляє собою кількість адсорбтиву, що міститься в об'ємі адсорбційного шару і припадає на одиницю поверхні адсорбенту (абсолютна адсорбція). Для пористих твердих адсорбентів точно визначити площу поверхні важко і в таких випадках адсорбцію відносять до одиниці маси адсорбенту (моль/кг).
Значення А не збігається із гіббсівською величиною адсорбції Г, тому що воно дорівнює загальній кількості адсорбтиву в поверхневому шарі, а Г – надлишок адсорбтиву в цьому шарі порівняно з об'ємом фази. Однак якщо взяти до уваги, що при адсорбції газів та пари, а також речовин із розведених розчинів кількість адсорбтиву в об'ємі набагато менша, ніж у поверхневому шарі, то і А мало відрізняється від істинної адсорбції Г, тобто можна вважати А ≈ Г.
Дж. Гіббс застосував закони термодинаміки до поверхневих явищ і не враховуючи природи сил, які приводять до адсорбції речовин на межі поділу фаз, та механізму явища, вивів рівняння зв'язку між адсорбцією Г та зміною поверхневого натягу σ з концентрацією розчину. Так, для розрахунку адсорбції в реальному розчині придатне рівняння Гіббса у такій формі:

де а – рівноважна активність речовини в об'ємі розчину.
У розведених розчинах можна вважати а ≈ с, де с – рівноважна концентрація речовини, тоді дане рівняння застосовують у менш строгому записі
 .
.
Для ідеальних газів
 .
.
Отримане Гіббсом рівняння ізотерми адсорбції є найважливішим термодинамічним рівнянням, справедливим для будь-яких складів та різних меж поділу фаз; рідина–газ, газ–тверде тіло, рідина–рідина. Експериментальна перевірка рівняння Гіббса була проведена багатьма дослідниками (Мак-Бен, Фрумкін, Льюїс) за допомогою різних методів і дала задовільний збіг дослідних та обчислених величин Г.
Для теоретичного розрахунку адсорбції необхідно знати похідну dσ/dc, яку знаходять із експериментально отриманої залежності а = f(c) – dc.
Але на сьогодні не існує надійних прямих методів вимірювання σ на межі твердих тіл газом або розчином, тому рівняння Гіббса практично застосовується для розрахунку адсорбції тільки на рідких поверхнях.
З рівняння Гіббса випливає, що при – dσ/dc >0, Г > 0, при – dσ/dc < 0, Г < 0, а при – dσ/dc = 0, Г = 0. Ребіндер запропонував величину – dσ/dc прийняти за міру здатності речовини знижувати вільну поверхневу енергію на даній межі поділу,позначивши її g та назвавши поверхневою активністю: g = – dσ/dc.
Величина похідної залежить від концентрації, тому, щоб виключити її вплив, беруть граничне значення g при а ® 0 (с ® 0). Враховуючи це, Ю. Г. Фролов (1987 р.) дав визначення поверхневої активності у вигляді
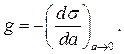
Поверхнева активність є важливою адсорбційною характеристикою речовини, яка визначає її властивість та області застосування.
Якщо із збільшенням концентрації речовини поверхневий натяг на межі поділу фаз знижується, то така речовина називається поверхнево-активною. Речовини, які збільшують поверхневий натяг на межі поділу фаз із збільшенням концентрації, називаються поверхнево-інактивними.
 Як вже зазначалося, причиною адсорбції є здатність розчинених речовин змінювати поверхневий натяг розчинника. Склад поверхневого шару чистої рідини (розчинника) не відрізняється від складу об'єму рідини. Розчинення речовини, яка має поверхневий натяг σ, відмінний від поверхневого натягу розчинника σ0, призводить до зміни складу поверхневого шару. По мірі збільшення концентрації поверхнево-активної речовини (ПАР) поверхневий натяг розчинів зменшується (рис. 1.2, а), тобто знижується вільна енергія поверхневого шару. Таким чином, молекули ПАР самодовільно накопичуються на поверхні поділу фаз в надлишковій, в порівнянні з об'ємом, кількості, тобто відбувається позитивна адсорбція: Г > 0 (рис. 1.2, б).
Як вже зазначалося, причиною адсорбції є здатність розчинених речовин змінювати поверхневий натяг розчинника. Склад поверхневого шару чистої рідини (розчинника) не відрізняється від складу об'єму рідини. Розчинення речовини, яка має поверхневий натяг σ, відмінний від поверхневого натягу розчинника σ0, призводить до зміни складу поверхневого шару. По мірі збільшення концентрації поверхнево-активної речовини (ПАР) поверхневий натяг розчинів зменшується (рис. 1.2, а), тобто знижується вільна енергія поверхневого шару. Таким чином, молекули ПАР самодовільно накопичуються на поверхні поділу фаз в надлишковій, в порівнянні з об'ємом, кількості, тобто відбувається позитивна адсорбція: Г > 0 (рис. 1.2, б).

Рис. 1.2. Залежність поверхневого натягу (а) і гіббсівської адсорбції (б) від концентрації розчиненої речовини: 1 – поверхнево-активна речовина (додециламін); 2 – поверхнево-неактивна (інактивна, натрій сульфат); 3 – поверхнево-індиферентна (сахароза)
По відношенню до межі поділу вода (полярний розчинник) – повітря, поверхнево-активними речовинами є органічні речовини, які мають дифільну будову молекули, наприклад жирні кислоти, спирти, кетони, мила та ін. Вони містять в своєму складі неполярну частину – зокрема, вуглеводневий радикал і полярну частину, представлену функціональними групами –СООН, –ОН, –NH2, –SO2OH і т.д. Вуглеводневі ланцюги гідрофобні, причому чим довший ланцюг, тим сильніше виражені гідрофобні властивості молекули ПАР, тим сильніше виштовхується вона на поверхню і тим більше молекул накопичується у поверхневому шарі. Полярні групи, споріднені з водою (гідрофільні), гідратуються і зумовлюють задовільну розчинність ПАР у воді.
Поверхнево-інактивні речовини при розчиненні прагнуть перейти в об'єм розчину, їх концентрація на межі поділу фаз стає меншою, ніж в об'ємі, тому адсорбція буде негативною: Г < 0 (рис. 1.2, б). Це пояснюється тим, що енергія взаємодії їх молекул з молекулами розчинника вища, ніж енергія взаємодії молекул розчинника між собою. Поверхнево-інактивними речовинами по відношенню до межі поділу вода–повітря є неорганічні електроліти – кислоти, основи, солі, які добре розчиняються у воді і сильно гідратуються. Збільшення поверхневого натягу при цьому невелике (рис. 1.2, а) і стає істотним при порівняно високих концентраціях.
Існують також індиферентні речовини (рис. 1.2, а), які не змінюють поверхневого натягу розчинника.
Для розрахунку ізотерми адсорбції Г = f(c) необхідно знати залежність поверхневого натягу від концентрації розчиненої речовини. Схема графічного розрахунку показана на рис. 1.3.
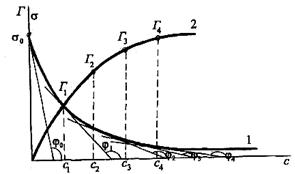
Рис. 1.3. Ізотерми поверхневого натягу (1) і адсорбції (2)
В декількох точках кривої σ = f(c), що відповідають концентраціям с1, с2, с3, с4 і т. д., проводять дотичні і визначають тангенси кута нахилу їх до осі абсцис φ, які дорівнюють значенням похідних dσ/dc в даних точках. Підставляючи їх у рівняння Гіббса, одержують відповідно величини Г1, Г2, Г3, Г4 і т. д., за якими будують ізотерму адсорбції Г = f (c).
Залежність σ = f(c) можна побудувати за експериментальними значеннями поверхневого натягу водних розчинів при різних концентраціях ПАР. Можна також скористатися емпіричним рівнянням Б. А. Шишковського:

або
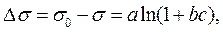
де σ0 і σ – поверхневий натяг розчинника і розчину відповідно, с – концентрація розчину ПАР, а і b – емпіричні сталі. Причому значення а мало залежить від природи ПАР і є єдиним для всього гомологічного ряду, a b називається питомою капілярною сталою, яка має певне значення для кожного члена гомологічного ряду.
Рівняння Шишковського застосовують для обчислення поверхневого натягу жирних кислот (або інших ПАР) з невеликим числом атомів вуглецю (до С8).
За допомогою рівняння Шишковського можна перейти від рівняння Гіббса до рівняння Ленгмюра. Якщо продиференціювати рівняння Шишковського за концентрацією:
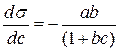
і підставити похідну в рівняння Гіббса, то одержимо:
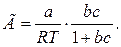
Позначивши a /RT через Г∞, a b – через К ураховуючи, що Г практично рівне А, маємо рівняння Ленгмюра:
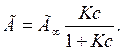
Таким чином, був установлений зв'язок між рівнянням Гіббса, виведеним за допомогою законів термодинаміки, і рівнянням Ленгмюра, що базується на молекулярно-кінетичних положеннях.
Поверхнева активність дифільних молекул залежить від довжини вуглеводневої групи. П. Дюкло та І. Траубе сформулювали таке правило: поверхнева активність жирних кислот, спиртів та інших дифільних сполук у водних розчинах однакової концентрації зі збільшенням довжини вуглеводневої групи на одну групу –CH2– збільшується у 3–3,5 рази, тобто
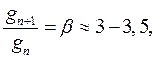
де g – поверхнева активність; n – число груп – CH2 –; β – коефіцієнт Траубе.
Правило Дюкло – Траубе найбільш точно виконується за низьких концентрацій розчинених речовин. Із нього випливає важливий висновок: площа, яка припадає на одну молекулу максимально насиченого поверхнево-активною речовиною адсорбційного шару, залишається сталою в межах гомологічного ряду.
Адсорбція на межі поділу тверде тіло – розчин для розведених розчинів добре описуються рівнянням Ленгмюра та Фрейндліха.
В області відносно високих заповнень поверхні адсорбцію часто виражають емпіричним рівнянням Фрейндліха:
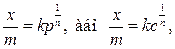
де х – кількість адсорбованої речовини; m – маса адсорбенту; р – рівноважний тиск; с – рівноважна концентрація, k і n – константи.
Найбільш вдале теоретичне рівняння, що описує адсорбційну рівновагу, запропоновано Ленгмюром:
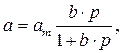
де b і аm – адсорбційні параметри; р – тиск газу (або с – концентрація розчину).
Рівняння ізотерми Ленгмюра на твердій поверхні:

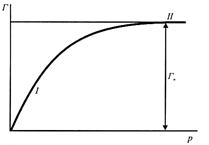
Загальний вигляд ізотерми Ленгмюра показано на рис. 1.4.
| 
|
| Рис. 1.4. Загальний вигляд ізотерми Ленгмюра | Рис. 1.5. Графічне визначення констант ізотерми адсорбції Ленгмюра |
Для експериментального визначення Г∞ і К рівняння Ленгмюра перетворюють у рівняння прямої

і будують графік залежності 1/Г від 1/С (рис. 1.5).
Тангенс кута нахилу прямої α дорівнює 1/Г∞К, а відрізок ОА на осі ординат дорівнює 1/Г∞.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 5351; Нарушение авторских прав?; Мы поможем в написании вашей работы!