
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина
|
|
|
|
Реактиви та обладнання: колби ємністю 100 см3 – 5 шт; піпетка на 10 см3 – 1 шт, бюретки на 50 см3 – 4 шт; хімічні лійки – 5 шт; водний розчин NaOH (0,2 H); водний розчин NaOH (0,02 H); водний розчинСН3СООН(0,4 H); фільтрувальний папір; активоване вугілля.
Методичні вказівки
Із 0,4 H розчину оцтової кислоти методом розведення водою готують наступні розчини.
Таблиця 1.3
Досліджувані розчини
| № розчинів | |||||
| СН3СООН см3 | 2.5 | ||||
| Н2О см3 | 37.5 |
Із кожної колбочки відбирають піпеткою по 10 см3 розчину і титрують їх розчином лугу в присутності фенолфталеїну, визначаючи концентрацію вихідних розчинів. Розчини перших трьох колб титрують 0,2 Н розчином NaOH, а 4 і 5 колбу – 0,02 H NaOH.
Кожну з колб, в яких залишилося по 30 см3 розчину вносять по 0,5 г активованого вугілля і витримують їх впродовж 30 хв, періодично перемішуючи. Після цього вміст всіх колб фільтрують в 5 сухих колб. Із кожного фільтрату знову відбирають піпеткою по 10 см3 розчину і титрують в присутності фенолфталеїну, як і в попередньому випадку: розчини 1, 2, 3 – титрують 0,2 H, а 4 і 5 – 0,02 H розчином натрій гідроксиду. За даними титрування визначають концентрації кислоти в кожній колб до адсорбції (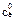 ) і після адсорбції (
) і після адсорбції (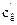 ) в моль/л, які розраховують за формулою:
) в моль/л, які розраховують за формулою:
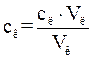 , (1.3)
, (1.3)
де Vл, Vк – об’єм розчину лугу і кислоти.
Кількість адсорбованої кислоти на одиницю маси адсорбенту в моль/л визначають за формулою:
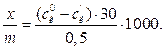 (1.4)
(1.4)
де x – кількість адсорбованої кислоти в моль/л; m – маса адсорбенту (0,5 г); 30 – об’єм в мл розчину, з якого проводилась адсорбція; 1000 – коефіцієнт переводу молів у мілімолі.
Таблиця 1.4
Результати досліджень
| № роз-чину | До адсорбції | Після адсорбції | 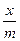
| 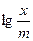
| 
| ||||||
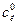
| 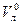
| 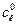
| 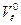
| 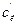
| 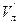
| 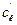
| 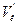
| ||||
| 0,2 | 0,2 | ||||||||||
| 0,2 | 0,2 | ||||||||||
| 0,2 | 0,2 | ||||||||||
| 0,2 | 0,02 | ||||||||||
| 0,2 | 0,02 |
Оформлення протоколу: Використовуючи одержані дані побудувати графік в координатах 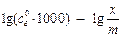 . За величиною тангенса кута нахилу одержаної прямої до осі абсцис визначити n, а за відрізком одержаним перетином прямої з віссю ординат –
. За величиною тангенса кута нахилу одержаної прямої до осі абсцис визначити n, а за відрізком одержаним перетином прямої з віссю ординат –  . Записати рівняння адсорбції, встановивши значення n і
. Записати рівняння адсорбції, встановивши значення n і  .
.
ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Як на практиці визначити адсорбцію кислоти із розчину і знайти її рівноважну концентрацію?
2. Запишіть рівняння ізотерми обмінної адсорбції із бінарних розчинів. Поясніть величини, що входять в цей вираз.
3. Сформулюйте правило зрівнювання полярностей адсорбції із розчинів твердими адсорбентами.
4. В чому полягає специфіка адсорбції сильних електролітів твердими адсорбентами? Що таке ліотропні ряди?
5. Які переваги і недоліки при використанні рівняння адсорбції Фрейндліха для опису залежностей адсорбція – концентрація адсорбату в розчинах?
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 458; Нарушение авторских прав?; Мы поможем в написании вашей работы!