
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обробка результатів
|
|
|
|
Методичні вказівки
Експериментальна частина
Реактиви та обладнання: віскозиметр, дистильована вода, розчин полімеру, секундомір, набір конічних колб.
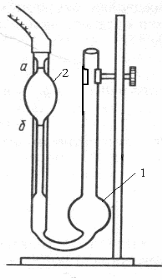
|
| Рис.Капілярний віскозиметр |
1. У капілярний віскозиметр (рис.), через широке коліно в ємність 1, наливають 10 мл розчинника (дистильована вода).
2. За допомогою груші через капіляр затягнути розчинник на 1 – 2 см вище мітки над ємністю 2.
3. Зняти грушу. Як тільки меніск рідини зрівняється з верхньою міткою над ємністю 2, пустити секундомір та визначити час витікання розчинника з ємності 2 між двома мітками.
4. Операції 2–3 повторити 3 рази. Записати середнє значення часу витікання. Замінити розчинник розчином ВМС та виміряти час його витікання згідно з пп. 3. По черзі провести вимірювання для розчинів заданих концентрацій.
1. Записати одержані дані в табл.:
| С, % | τ, с | hвідн | hпит | hпр |
| 1… | ||||
| 7 |
2. За даними таблиці побудувати графік hпр = f(C) та згідно з рис. провести визначення характеристичної в’язкості [h]. Якщо отримана залежність має яскраво виражений нелінійний характер, то операцію екстраполяції провести в координатах ln(hвідн)/C = f(C).
3. Обчислити молярну масу ВМС, використавши відповідні для даного полімеру значення констант K та a (табл.).
| Полімер | Розчинник | t, 0C | K.10–4 | a | Діапазон M.10–3, в якому визначені константи |
| Поліакриламід | Вода | 0,631 | 0,8 | 10 – 5000 | |
| Полівініловий спирт | Вода | 3,0 | 0,5 | 8,5 – 1700 | |
| Поліетиленоксид | Вода | 1,66 | 0,82 | 0,4 – 4,0 | |
| Ацетат целюлози | Ацетон | 0,19 | 1,03 | 11 – 130 |
ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Чим відрізняється механізм розчинення полімерів від механізму розчинення низькомолекулярних речовин?
2. Поясніть, чому розчини ВМС є стійкими системами. Що таке висолювання?
3. Чим відрізняються між собою аномальна, структурна, приведена, характеристична в’язкість розчинів ВМС?
4. Яке рівняння використовують для визначення осмотичного тиску ВМС?
5. На чому оснований віскозиметричний метод визначення молекулярної маси ВМС?
6. Які речовини відносяться до поліелектролітів?
7. Дайте визначення ізоелектричної точки поліелектролітів. Які методи її визначення?
8. Яке біологічне значення мають процеси: коацервація, мікрокапсулювання, мікрокоацервація?
9. Що визначають за допомогою мембранної рівноваги Доннана?
10. Які системи відносяться до драглів? Приведіть їх властивості.
ПЕРЕЛІК ПИТАНЬ, ЯКІ ВИНОСЯТЬСЯ НА МОДУЛЬ 2 «КОЛОЇДНА ХІМІЯ»
1. Поверхневі явища та їх значення для фармації. Поверхнева енергія та поверхневий натяг. Когезія та адгезія.
2. Явище змочування. Крайовий кут змочування. Рівняння Юнга. Вибіркове змочування. Теплота змочування. Коефіцієнт гідрофільності.
3. Сорбційні процеси і їх класифікація. Адсорбція: основні поняття та визначення. Термодинамічне рівняння адсорбції Гіббса.
4. Адсорбція на межі рідина-газ. Поверхневий натяг розчинів. Поверхнево-активні і поверхнево-інактивні речовини.
5. Рівняння Шишковського. Взаємозв’язок між термодинамічною теорією адсорбції Гіббса та молекулярно-кінетичною теорією мономолекулярної адсорбції Ленгмюра.
6. Поверхнева активність. Правило Дюкло-Траубе. Будова мономолекулярного шару. Визначення розмірів молекули ПАР.
7. Теорія мономолекулярної адсорбції Ленгмюра. Рівняння ізотерми адсорбції Ленгмюра, його виведення і аналіз.
8. Теорія полімолекулярної адсорбції (БЕТ, Поляні).
9. Адсорбція на межі тверде тіло – газ. Загальні положення та основні теорії. Фактори, що впливають на адсорбцію газів і розчинених речовин.
10. Емпіричне рівняння адсорбції Фрейндліха. Визначення констант рівняння Фрейндліха. Графічним і алгебраїчним методами.
11. Адсорбція на межі тверде тіло – розчин. Молекулярна адсорбція із розчинів. Правило зрівнювання полярності (П. О. Ребіндер). Гідрофільні і гідрофобні адсорбенти.
12. Адсорбція електролітів. Еквівалентна та вибіркова адсорбція сильних електролітів. Правило Панета-Фаянса.
13. Йонообмінна адсорбція. Йоніти, їх класифікація і застосування у фармації.
14. Поняття про хроматографію. Класифікація та застосування хроматографічних методів дослідження.
15. Предмет колоїдної хімії та її значення у фармації. Поняття про дисперсні системи. Класифікація дисперсних систем.
16. Диспергаційні методи одержання колоїдних систем. Явище пептизації, його суть.
17. Конденсаційні методи одержання колоїдних систем.
18. Способи очищення колоїдних розчинів. Діаліз, електродіаліз, ультрафільтрація. “Штучна нирка”.
19. Молекулярно-кінетичні властивості колоїдних систем. Броунівський рух. Рівняння Ейнштейна-Смолуховського. Дифузія в колоїдних системах. Закон Фіка.
20. Осмотичний тиск в колоїдних системах. Рівняння Вант-Гоффа. Поняття про ізотонічні, гіпотонічні та гіпертонічні розчини. Їх застосування в медицині та фармації.
21. Седиментація. Седиментаційно-дифузійна рівновага. Седиментаційний аналіз дисперсних систем.
22. Оптичні властивості колоїдних розчинів. Розсіювання та поглинання світла. Ефект Тіндаля. Рівняння Релея.
23. Оптичні методи дослідження дисперсних систем (нефелометрія, турбідиметрія, ультрамікроскопія, світлова і електронна мікроскопія).
24. Електричні властивості колоїдно-дисперсних систем. Поверхневий (електротермодинамічний) φS-потенціал. Механізм утворення ПЕШ. Теорії будови подвійного електричного шару Гельмгольца-Перрна, Гуї-Чепмена, Штерна, сучасна будова ПЕШ. Ізоелектричний стан колоїдних систем.
25. Електрокінетичний потенціал або дзета-потенцал (ζ-потенціал). Рівняння Гельмгольца-Смолуховського. Вплив різних факторів на електрокінетичний потенціал.
26. Будова колоїдної міцели.
27. Класифікація електрокінетичних явищ: електрофорез, електроосмос, потенціал седиментації (осідання), потенціал протікання. Практичне застосування електрокінетичних явищ у техніці, медицині і фармації.
28. Стійкість колоїдних розчинів. Класифікація стійкості та нестійкості дисперсних систем. Фактори стійкості.
29. Коагуляція і фактори, що її викликають. Поріг коагуляції та його визначення. Правило значності (правило Шульце-Гарді). Ліотропні ряди йонів електролітів.
30. Кінетика коагуляції (прихована, повільна та швидка коагуляція).
31. Фізична теорія стійкості і коагуляції. Теорія коагуляції ДЛФО. Нейтралізаційна та концентраційна коагуляція.
32. Коагуляція сумішами електролітів (адитивність, антагонізм і синергізм електролітів).
33. Взаємна коагуляція. Явище звикання золів. Колоїдний захист і сенсибілізація та їх застосування при виготовленні лікарських форм.
34. Дисперсні системи з газовим дисперсійним середовищем. Аерозолі. Класифікація, одержання, властивості. Методи руйнування аерозолів. Застосування аерозолів у фармації.
35. Порошки та їх властивості. Злежування, грануляція та розпилювання порошків. Застосування порошків у фармації.
36. Дисперсні системи з рідким дисперсійним середовищем. Суспензії. Стійкість суспензій. Седиментаційний аналіз суспензій (М. А. Фігуровський).
37. Пасти. Застосування суспензій і паст у фармації.
38. Емульсії. Методи одержання і властивості. Типи емульсій.
39. Гідрофільно-ліпофільний баланс (ГЛБ) для ПАР. Емульгатори. Обернення фаз у емульсіях. Застосування емульсій у фармації.
40. Піни. Одержання і руйнування пін. Застосування пін у побуті і в медицині.
41. Колоїдні поверхнево-активні речовини (ПАР), класифікація, будова та властивості.
42. Міцелоутворення в розчинах ПАР. Критична концентрація міцелоутворення. Солюбілізація. Застосування колоїдних ПАР.
43. Високомолекулярні сполуки – основа живих організмів. Поняття та класифікація ВМС. Методи одержання ВМС.
44. Гнучкість макромолекул. Фазові і фізичні стани ВМС.
45. Особливості розчинів ВМС. Механізм набрякання та розчинення ВМС. Залежність набрякання та розчинення ВМС від різних факторів.
46. В’язкість розчинів ВМС (аномальна, структурна, приведена, характеристична). Рівняння Ньютона і Пуазейля та відхилення від них розчинів ВМС.
47. Віскозиметричний метод визначення молекулярної маси ВМС. Застосування ВМС у медицині та фармації.
48. Осмотичний тиск ВМС. Рівняння Галлера.
49. Поліелектроліти. Будова молекули, класифікація. Ізоелектрична точка поліелектролітів і методи її визначення.
50. Коацервація. Мембранна рівновага Доннана. Значення цього процесу для вивчення транспорту лікарських речовин у клітини організму.
51. Драглювання розчинів ВМС. Властивості драглів (гелів). Вплив рН середовища, температури та електролітів на швидкість драглювання. Тиксотропія і синерезис. Дифузія у драглях.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 758; Нарушение авторских прав?; Мы поможем в написании вашей работы!