
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Tetracaini hydrocloridum 2 страница
|
|
|
|

Природні джерела цих алкалоїдів – листя чаю, боби какао, зерна кофе. Зараз їх добувають синтетичним шляхом із сечової кислоти.
Властивості. Кофеїн - білий кристалічний порошок, легко сублімується помірно розчинний у воді, лгко розчинний у киплячій воді мало розчинний 96% спирті і ефірі. Розчиняється в концентрованих розчинах лужних бензоатів та саліцилатів.
Теобромін – білий кристалічний порошок, гіркий на смак, дуже мало розчинний у воді, спирті, ефірі та хлороформі, мало розчинний у гарячій воді, легко розчинний у розведених кислотах та лугах.
Теофілін - білий кристалічний порошок, мало розчинний у воді, спирті, та хлороформі, легко розчинний у гарячій воді, розчинний у розведених кислотах та лугах.
Кофеїн – дуже слабка основа, утворює з кислотами нестійкі солі за рахунок азоту у положенні 9.
Теофілін і теобромін – амфотерні сполуки з перважанням кислотних властивостей (за рахунок рухомого атома водню при азоті в положенні 1 або 7).
Ідентифікація:
· групова реакція на ксантини – це мурексидна проба або реакція на алкалоїди пуринового ряду. Субстанцію у порцеляновій чашці обробляють окисником (перекисом водню, бромом, конц. азотною кислотою) і випарюють на водяному нагрівачі досуха. При змочуванні залишку 1-2 краплями розчину аміаку з’являється пурпурово-червоне забарвлення:

Специфічні реакції:
Кофеїн:
За фізико-хімічними константами: ІЧ-спектроскопія, температура топлення.
Реакція з розчином калію йодиду йодованим у присутності кислоти хлористоводневої розведеної – утворюється коричневий осад, який розчиняється при нейтралізації розчином натрію гідроксиду розведеним.
Реакція з ацетилацетоном і диметиламінобензальдегідом. Розчин субстанції у суміші ацетилацетону і розчину натрію гідроксиду розведеного нагрівають на водяній бані, охолоджують, додають розчин диметиламінобензальдегіду і ще раз нагрівають. Охолоджують і додають воду – з’являється інтенсивне синє забарвлення.
Субстанція дає реакцію на ксантини.
з розчином таніну утворюється білий осад, розчинний в надлишку реактиву.
Теобромін:
· Реакція його натрієвої солі, отриманої при взаємодії лугу з надлишком теоброміну (використовують фільтрат), з розчином кобальту хлориду – з’являється інтенсивне фіолетове забарвлення, яке швидко зникає, і утворюється осад сірувато-блакитного кольору.
· Реакція натрієвої солі теоброміну з розчином аргентуму нітрату – утворюється густа желатиноподібна маса (срібна сіль), яка розріджується при нагріванні до 80ºС і знову застигає при охолодженні.
Теофілін:
-Реакція натрієвої солі теоброміну з розчином кобальту хлориду -
утворюється білий з рожевим відтінком осад кобальтової солі (подібно до утворення срібної солі в кількісному визначенні).
-З лужним розчином натрію нітропрусиду утворюється зелене забарвлення, яке зникає при додаванні надлишку кислоти.
Кількісне визначення:
1. Ацидиметрія в неводному середовищі у суміші кислоти оцтової безводної, оцтового ангідриду та толуолу, пряме титрування потенціометрично, s = 1. (ДФУ).
2. Йодометрія, зворотне титрування, індикатор – крохмаль, s = 1/2.

Теобромін і теофілін визначають методом алкаліметрії за замісником (непряма алкаліметрія), який грунтується на утворенні срібних солей із виділенням еквівалентних кількостей кислоти азотної, яку відтитровують розчином натрію гідроксиду, індикатор – феноловий червоний, s = 1:

Зберігання: лікарські засоби пуринових алкалоїдів зберігають у добре укупореній тарі. Теофілін оберігають від дії світла.
Застосування: кофеїн як стимулятор ЦНС, кардіотонічний засіб; теобромін і теофілін – спазмолітичні і діуретичні засоби.

Властивості: білий порошок без запаху, гіркуватого смаку. Легко розчинний у воді, важко – у спирті.
Ідентифікація:
1. Кофеїн:
· За температурою топлення (234-237ºС) після екстрагування хлороформом з лужного розчину;
· Мурексидною пробою;
· З розчином таніну;
· З розчином йоду.
2. Натрію бензоат підтверджують:
· Реакцією з розчином хлориду заліза – осад рожево-жовтого кольору;
· Катіон натрію по забарвленню полум’я в жовтий колір.
Кількісне визначення:
1. Кофеїн йодометрично (див. кофеїн). У перерахунку на суху речовину його має бути не менше 38,0% і не більше 40,0%.
2. Натрію бензоат визначають ацидиметрично в присутності змішаного індикатора (метиловий оражевий та метиленовий синій 1:1) та ефіру для екстрагування бензойної кислоти, що виділяється у процесі титрування, s = 1.

Натрію бензоату в перерахунку на суху речовину має бути не менш 58,0% і не більш 62,0%.
Зберігання: у сухому добре захищеному від світла місті.
Застосування: як стимулятор ЦНС, кардіотонічний засіб.

Властивості: білий кристалічний порошок без запаху. Гігроскопічний, дуже легко розчинний у воді, легко розчинний у спирті, практично не розчинний у ефірі та хлороформі.
Ідентифікація:
-Субстанція дає реакцію на хлориди.
-Реакція утворення надхромових кислот () суміш перекису водню, кислоти сірчаної концентрованої та калію дихромату), які в присутності пілокарпіну екстрагуються хлороформом і забарвлюють хлороформний шар у синьо-фіолетовий колір. За відсутності пілокарпіну забарвлений продукт хлороформом не екстрагується.
-Питоме обертання від +88,5º до +91,0º(2 % водний розчин).
-Реакція Регаля на лактонне кільце. З натрію нітропрусидом в лужному середовищі – вишневе забарвлення, яке не зникає при додаванні надлишку кислоти хлористоводневої.
-Гідроксамова проба:
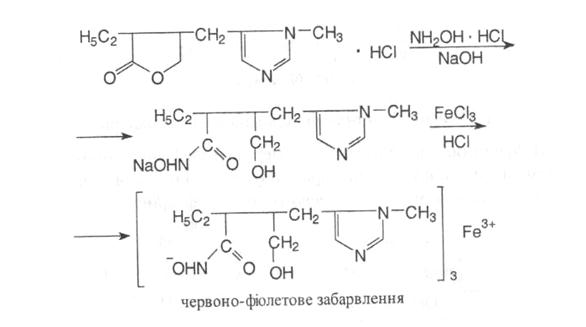
Кількісне визначення:
-Ацидиметрія в неводному середовищі, в присутності ацетату ртуті, s = 1.
-Алкаліметрія в спиртовому середовищі, s = 1.
Зберігання: у сухому добре захищеному від світла та вологи місті.
Застосування: Холінолітичний (міотичний) засіб. Призначають у вигляді очних крапель або мазі для лікування глаукоми.
ЛЕКЦІЯ № 16
Тема: Лікарські засоби групи гліцидів.
ПЛАН
· Загальна характеристика гліцидів.
· Глюкоза.
· Кальцію глюконат.
Гліциди (вуглеводи) – група органічних сполук, що складаються з вуглецю, водню та кисню. Більшість з них відповідають загальній формулі Сm(H2O)n. За хімічними властивостями гліциди – це полігідроксильні сполуки, що містять або утворюють під час гідролізу альдегідну або кетонну групи.
Гліциди (вуглеводи) класифікують:
· За кількістю атомів вуглецю в молекулі – тетрози, пентози, гексози, гептози та ін.;
· За основною функціональною групою – альдози і кетози;
· За кількістю атомів у циклі (для циклічних структур) – фуранози і піранози;
· За кількістю моносахаридних одиниць у молекулі – прості вуглеводи (моносахариди, монози), олігосахариди (від 2 до 10 моносахаридів) і плісахариди (понад 10 моносахаридів).

Очищають глюкозу перекристалізацією з водних або водно-спиртових розчинів, причому, якщо кристалізацію вести при температурі понад 30ºС – отримують безводну глюкозу, а при температурі нижчій від 30ºС – кристалогідрат, що містить одну молекулу води: C6H12O6. H2O.
Властивості: білий кристалічний порошок солодкого смаку, легко розчинний у воді, помірно – у 96% спирті.
І дентифікація:
Питоме обертання від + 52,5º до + 53,3º у перерахунку на суху речовину. Визначення проводять для 10% водного розчину в присутності розчину аміаку.
Для глюкози є характерним явище мутаротації, тобто зміни з часом кута обертання свіжовиготовлених розчинів вуглеводів. Для прискорення встановлення рівноваги як каталізатор додають декілька крапель розчину аміаку.
Тонкошарова хроматографія.
При нагріванні субстанції з розчином мідно-тартратного реактиву (реактив Фелінга) утворюється червоний осад, крім реактиву Фелінга для окиснення глюкози може бути використаний аміачний розчин срібла нітрату та реактив Несслера:

З фенілгідразином глюкоза утворює осад фенілгідразону, який при нагріванні утворює озазон жовтого кольору з характерною температурою топлення:

При взаємодії з мінеральними кислотами та кислотою щавлевою при нагріванні глюкоза утворює оксиметилфурфурол:

Оксиметилфурфурол – летка сполука, яка взаємодіє з аналіном або новокаїном, нанесеним на фільтрувальний папір, котрим закривають пробірку. Спочатку утворюється основа Шиффа світло-жовтого кольору, а потів фурановий цикл розкривається з утворенням поліметинового барвника, що має малиново-фіолетове забарвлення.
Експрес–реакція:
· з тимолом та кислотою сірчаною концентрованою утворюється темно-червоне забарвлення;
· при взаємодії з резорцином і кислотою хлористоводневою розведеною – при нагріванні до кипіння з’являється рожеве забарвлення.
Кількісне визначення: ДФУ не передбачає визначення кількісного вмісту глюкози в субстанції. Вміст глюкози в розчинах для ін’єкцій визначають:
· методом рефрактометрії;
· поляриметрія;
· йодометрія, зворотне титрування, індикатор крахмаль, s = 1.
До субстанції додають надлишок титрованого розчину йоду і розчин натрію гідроксиду:
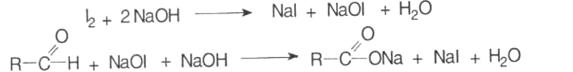
Через 10-15 хвилин додають розчин кислоти сірчаної і надлишок йоду відтитровують натрію тіосульфатом:

Властивості: білий кристалічний порошок, помірно розчинний у воді, легко розчинний у киплячій воді.
Ідентифікація:
· Метод тонкошарової хроматографії.
· Субстанція дає реакції на кальцій з оксалатом амонію утворюється білий осад.

· З гліоксальгідроксианілом в присутності натрію гідроокису, натрію карбонату та хлороформу. Хлороформний шар при струшуванні набуває червоного кольору:

· З розчином хлориду заліза утворюється ясно-зелене забарвлення
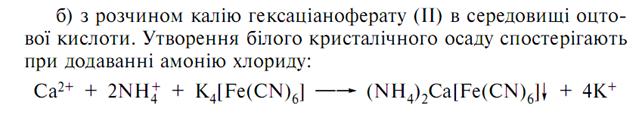
(на глюконат-йон).
Кількісне визначення:
Метод комплексонометрії, в присутності аміачного буферного розчину, індикатор кислотний хром чорний спеціальний або кальконкарбонова кислота, титрують розчином едетату натрію від червоно-фіолетового до синього забарвлення, s = 1.
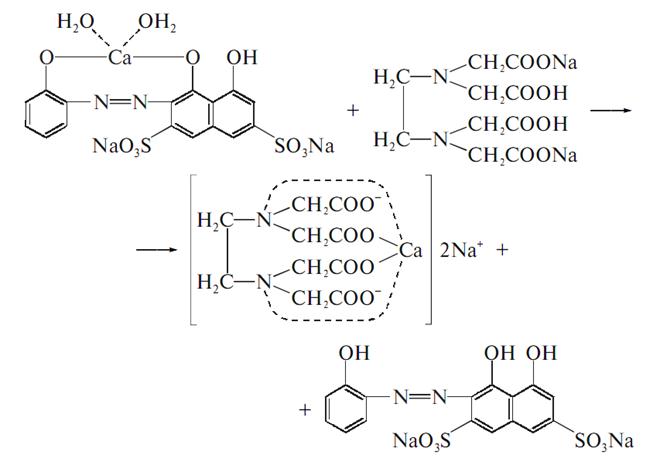
Зберігання: у добре укупореній тарі.
Застосування: є аналогом кальцію хлориду, антиалергійний, протизапальний, кровоспинний засіб.
ЛЕКЦІЯ № 17
Тема: Лікарські засоби групи вітамінів.
ПЛАН
1. Загальна характеристика вітамінів.
2. Класифікація.
3. Вітаміни аліфатичного ряду, кислота аскорбінова.
Вітаміни – це складні, біологічно активні органічні сполуки різноманітної хімічної природи, які надходять в організм людини та тварин в незначних кількостях, але відіграють велику роль в процесах обміну речовин, зокрема, в процесах біокаталізу. Відсутність або недостача вітамінів викликають глибокі порушення в організмі, що супроводжуються важкими захворюваннями. При недостатньому надходженні вітамінів розвиваються стани, що називаються гіповітамінозами, хвороби, пов’язані з відсутністю вітамінів, називаються авітамінозами, полівітамінозами (недостача декількох вітамінів).
В деяких випадках вітаміни утворюються в тканинах тварин у результаті хімічних перетворень речовин, які є їх попередниками (провітамінами).
Спочатку вітаміни класифікували за літерами латинського алфавіту по мірі їх відкриття, а також за їх біологічним значенням.
Так, токоферол, той що несе дітонародження, С – антискорбутний. Крім того введена класифікація за фізичними властивостями, згідно якої вітаміни діляться за розчинністю на дві великі групи: водо- та жиророзчинні.
Найбільш досконалою є хімічна класифікація, згідно якої всі вітаміни ділять на такі групи:
І. Вітаміни аліфатичного ряду: кислота аскорбінова (вітамін С), кислота пангамова (вітамін В15), кислота пантотенова (вітамін В3).
ІІ. Вітаміни аліциклічного ряду: ретиноли (вітаміни групи А), кальцифероли (вітаміни групи Д).
ІІІ. Вітаміни ароматичного ряду: вітаміни групи К.
ІV. Вітаміни гетероциклічного ряду: токофероли (вітаміни групи Е), біофлавоноїди (вітаміни групи Р). нікотинова кислота та її амід (вітаміни групи РР). піридоксини (вітаміни групи В6), тіамін (вітамін В1), рибофлавін (вітамін В2), кобаламіни (вітаміни групи В12).
Вітаміни аліфатичного ряду
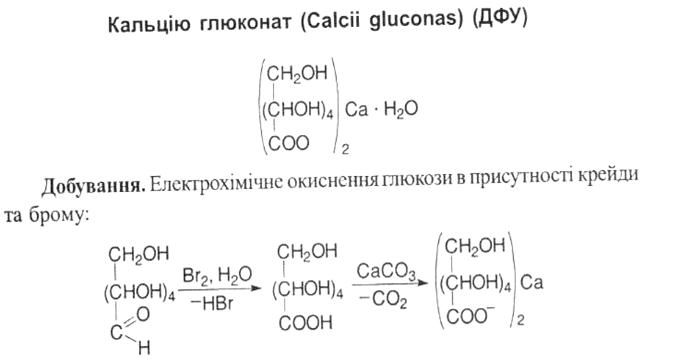
До похідних поліокси- γ-лактонів ненасичених карбонових кислот належить аскорбінова кислота. До вітамінів аліфатичного ряду, похідних ефірів глюконової кислоти, належить кислота пангамова
(вітамін В15). У медицині використовують її кальцієву сіль. Кислота пангамова входить до складу рисових висівок, дріжжів, крові, печінки. За хімічною структурою це ефір D-глюконової і диметиламінооцтової кислоти.
До похідних β-амінокислот належить пантотенова кислота. Нею багаті дріжжі, ікра, печінка та яєчний жовток. У медичній практиці застосовується кальцієва сіль кислоти пантотенової.

Аскорбінова кислота широко розповсюджена у природі. Особливо багатий на неї рослинний світ: салати, капуста, фрукти, глиця та ін. Хімічна структура аскорбінової кислоти вперше встановлена в 1933 році і в цьому ж році вперше здійснено її синтез. Тоді ж було виявлено, що аскорбінова кислота має сильні відновлюючі властивості.
Зараз у промисловості аскорбінову кислоту синтезують з D-глюкози.
Властивості: кристалічний білий порошок, що може змінювати колір під впливом повітря та вологи. Легко розчинний у воді, розчинний у 96% спирті, практично нерозчинний у ефірі. Плавиться при 190ºС із розкладанням.
За рахунок ендіольного угрупування проявляє одночасно відновні і кислотні властивості. Кислотний характер обумовлений рухомістю водню гідроксильної групи у положенні 3; при титруванні лугом аскорбінова кислота поводиться як одноосновна кислота.
Окиснюється у дві стадії:
1. оборотний процес окиснення до дегідроаскорбінової кислоти (кетонна група);
2. необоротний процес окиснення, який призводить до утворення фурфуролу:
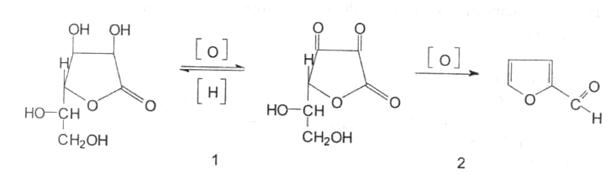
Ідентифікація:
1. За фізико-хімічними константами: УФ- та ІЧ-спектроскопія, рН та питоме оптичне обертання.
2. До розчину кислоти аскорбінової додають кислоту азотну розведену та розчин срібла нітрату – випадає сірий осад металічного срібла:

3. При додаванні по краплях розчину 2,6-дихлорфеноліндофенолу його синє забарвлення зникає:

4. З сульфатом заліза в присутності натрію гідрокарбонату утворює аскорбінат заліза, забарвлений у фіолетовий колір:

5. З фериціанідом калію в присутності з розведеною хлористоводневою кислотою та з послідуючим додаванням розчину хлориду заліза утворюється берлінська лазурь синього кольору.
6. З реактивом Фелінга мідь відновлюється до закису міді червоного кольору.
Кількісне визначення:
1. Йодометрія в присутності кислоти сірчаної розведеної, пряме титрування, індикатор крахмаль, s = 1.

2. Йодатометрія, пряме титрування в кислому середовищі в присутності калію йодиду, індикатор крохмаль, s = 3. У точці еквівілентності надлишок розчину калію йодату викликає синє забарвлення розчину:

4. Для визначення вмісту аскорбінової кислоти в рослинній сировині проводять титрування розчином натрію 2,6-дихлорфеноліндофеноляту, s = 1.
5. Інші окисно-відновні методи (йодхлорметрія, цериметрія).
Зберігання: у добре укупореній тарі темного скла.
Застосування: Перекисне окислення ліпідів (ПОЛ) є однією з форм тканинного дихання. Цей процес властивий нормальним тканинам і відбувається, як правило, при побудові ліпідних мембранних структур, їх оновленні, у ході біосинтезу ряду гормонів. Проте вільнорадикальне окислення може активізуватися в несприятливій екологічній ситуації, під дією алкоголю, тютюнового диму, а також при багатьох захворюваннях внутрішніх органів. Надмірна активація процесів ПОЛ веде до порушення структури мембран, ліпідного обміну, здійснює токсичний вплив на тканини, сприяє посиленню лізису, окисленню сульфгідрильних груп білків і призводить до розвитку структурних змін при захворюваннях серцево-судинної системи, легень, шлунково-кишкового тракту [6, 9]. Регуляція стаціонарної концентрації перекисей ліпідів в біологічних мембранах здійснюється внаслідок збалансованої взаємодії реакцій утворення цих продуктів — реакцій оксидації, а також механізмів контролю, які ведуть до пригнічення їх утворення, — реакцій антиоксидації.
Оксиданти та антиоксиданти мають велике значення для життєдіяльності організму в підтриманні певного балансу між процесами утворення та розпаду перекисних сполук.
У профілактичних та лікувальних цілях при скорбуті, кровотечах, інфекційних захворюваннях, інтоксикаціях, захворюваннях печінки та нирок застосовують препарати аскорбінової кислоти.
ЛЕКЦІЯ № 18
Тема: Лікарські засоби групи антибіотиків
ПЛАН
4. Загальна характеристика антибіотиків.
5. Класифікація.
6. Антибіотики гетероциклічної структури: пеніциліни, натрієва та калієва сіль пеніциліну.
7. Антибіотики ароматичного ряду:левоміцетин.
8. Антибіотики – аміноглікозиди: гентаміцину сульфат, канаміцину моносульфат.
Антибіотики – це хіміотерапевтичні речовини, які продукуються різноманітними мікроорганізмами, рослинами, тваринами в процесі їх життєдіяльності, а також їх синтетичні аналоги і похідні, що мають здатність убивати чи вибірково пригнічувати ріст збудників захворювань (бактерій, вірусів, грибів, найпростіших), затримувати розвиток злоякісних пухлин.
Англійський вчений Флемінг у 1928 році виявив у плісняви антибіотичні властивості. Чистий антибіотик – пеніцилін – виділили вчені Флорі та Чейн у 1934-1940 роках.
Антибіотики класифікують:
· за видами продуцента;
· залежно від характеру біологічної дії;
· за хімічною структурою.
Найбільш досконалою є хімічна класифікація, яка дозволяє вивчити залежність між хімічною структурою, фізико-хімічними властивостями і дією антибіотиків, також розробляти способи контролю якості анибіотиків, виходячи з особливостей структури.
За хімічною класифікацією виділяють:
1. Антибіотики аліциклічної будови (тетрацикліни, їх напівсинтетичні аналоги та ін.).
2. Антибіотики ароматичного ряду (група левоміцетину).
3. Антибіотики гетероциклічної структури (пеніциліни, їх напівсинтетичні аналоги, цефалоспорини та ін.).
4. Антибіотики глікозидної будови:
1. Стрептоміцини;
2. Аміноглікозиди (канаміцини, неоміцини, гентаміцини, мономіцини);
3. Макроліди (еритроміцини й олеандоміцини);
4. Анзаміцини (рифампіцини, їх напівсинтетичні аналоги).
5. Полієнові антибіотики з глікозидоподібною структурою (ністатин, амфотетицин, мікогептин).
6. Антибіотики поліпептидної будови (граміцидини, поліміксини та ін.).
7. Протипухлинні антибіотики:
· Похідні ауреолової кислоти;
· Антрацикліни;
· Похідні хінолін -5,8-діону;
· Актиноміцини.
Способи добування антибіотиків можна поділити на три групи:
1. Мікробіологічний синтез на основі плісняв (Penicillium) або променистих (Streptomices) грибів. Цим способом отримують анатибіотики тетрациклінового ряду, природні пеніциліни, антибіотики-глікозиди, макроліди та ін.
Даний метод грунтується на біосинтезі, який здійснюється в клітинах організму.
2. Хімічний синтез (левоміцетин та його похідні).
3. Поєднання мікробіологічного та хімічного синтезів. Використовується для добування напівсинтетичних антибіотиків на основі трансформації молекул природних антибіотиків (напівсинтетичні тетрацикліни, пеніциліни, цефалоспорини).
Для аналізу антибіотиків використовують біологічні, хімічні, фізичні і фізико-хімічні методи. Біологічні методи основані на порівняльній оцінці їх здатності пригнічувати розвиток тест-культури мікроорганізмів
(метод дифузіїї в агар та порівнянні дії певних концентрацій досліждуваного і стандартного зразків антибіотика на тест-мікроорганізм).
Біологічну активність антибіотиків виражають в одиницях дії (ОД). Це мінімальна кількість антибіотика, яка пригнічує розвиток тест-мікроорганізму в певному об’ємі живильного середовища. Кількість грамів діючої речовини в 1ОД для різних антибіотиків різна.
Антибіотики гетероциклічної структури
Пеніциліни

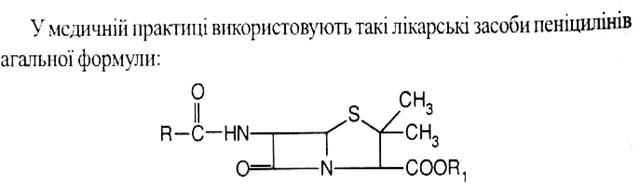

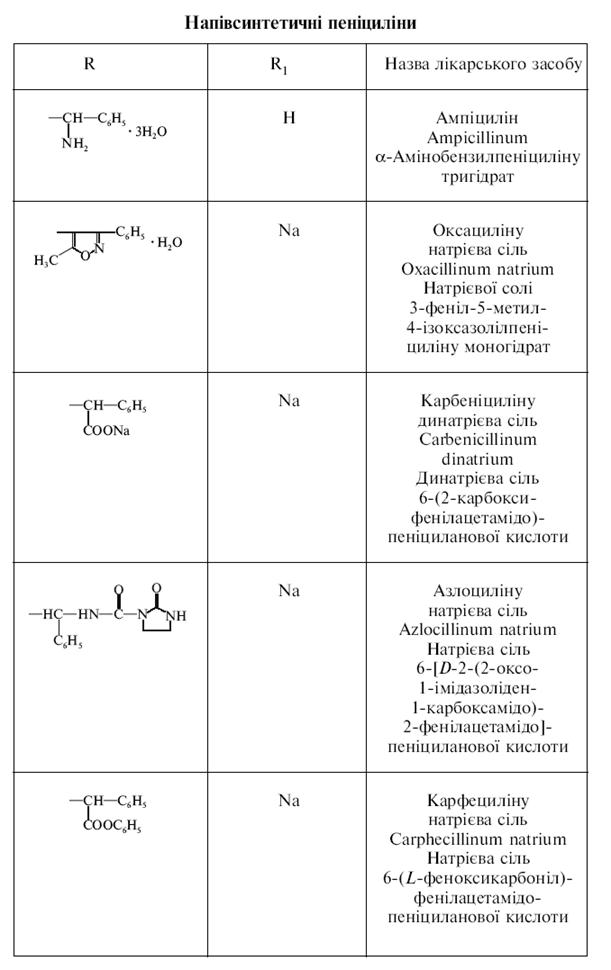
Використовують також комбінований препарат – ампіокс (ампіциліну та оксациліну натрієві солі).
Властивості: лікарські засоби природних та нпівсинтетичних пеніцилінів – це білі кристалічні речовини, без запаху, гіркі на смак. Натрієва і калієва солі безилпеніциліну гігроскопічні, легко розчиняються у воді. Водні і спиртові розчини пеніцилінів обертають площину поляризації променя праворуч.
Ідентифікація:
1. За фізико-хімічними константами: ІЧ- та УФ-спектроскопія, токошарова хроматографія.
2. Реакція з формальдегідом у присутності кислоти сірчаної концентрованої. Реакція специфічна, адже кожний пеніцилін утворює при цьому характерне забарвлення (бензилпеніциліни – червонувато-коричневе забарвлення, амоксицилін – темно-жовте).
3. Субстанції дають реакції на калій та натрій.
4. З розчином міді сульфату утворюють гідроксамати зеленого, а з розчином заліза хлориду червоного кольору:


5. Реакція з хромотроповою кислотою в присутності кислоти сірчаної концентрованої також є специфічною, адже кожний пеніцилін утворює при цьому продукт характерного забарвлення (бензилпеніциліни – коричневе забарвлення, ампіцилін – фіолетове).
6. Визначення органічно зв’язаної сірки після перетворення її в сульфід – іон при сплавленні з лугами.
Випробування на чистоту: вимірюють оптичну густину розчинів природних пеніцилінів при довжині хвилі 264, 280, 325нм. Специфічні домішки визначають методом рідинної хроматографії; залишкові кількості органічних розчинників – методом газової хроматографії. Ще визначають пірогени, аномальну токсичність і стерильність.
Кількісне визначення:
1. Метод рідинної хроматографії (ДФУ).
2. Мікробіологічний метод дифузіїї в агар.
3. Хімічні методи (йодометрія).
4. Спектрофотометричне визначення напівсинтетичних пеніцилінів.
Зберігання. У сухому місці при кімнатній температурі.
Застосування. Діють награмпозитивні мікроорганізми і використовуються для лікування пневмоній, гонореї, сифілісу, гнійних інфекцій, дифтерії, скарлатини. Не можна застосовувати через рот, оскільки в кислому середовищі відбувається інактивація. Стійкі в кислому середовищі феноксиметилпеніцилін та напісинтетичні пеніциліни.
Антибіотики ароматичного ряду
У медичній практиці із антибіотиків ароматичного ряду в медицині застосовується левоміцетин або хлорамфенікол, який було виділено в 1947 році а в 1949 році встановлено його хімічну структуру.

Левоміцетин синтезують з п-нітроацетофенону, отриману основу левоміцетину розділяють на оптичні антиподи послідовною кристалізацією з водного розчину або з використанням D-винної кислоти. Виділений D-трео-ізомер ацилують метиловим ефіром дихлороцтової кислоти і отримують левоміцетин.
Властивості. Левоміцетин і його стеарат – це білі з жовтуватим відтінком або жовтувато-зеленуватим відтінком кристалічні речовини без запаху, гіркого смаку, малорозчинний у воді, легкорозчинний у спирті. 5% розчини мають питоме обертання від +18º до - 21º.
Ідентифікація.
1. За фізико-хімічними константами: температура плавлення, Іч- та УФ- спектроскопія, токошарова хроматографія.
2. Реакція розщеплення в кислому або лужному середовищах з подальшою ідентифікацією утворених продуктів. Так, при нагріванні з розчином натрію гідроксиду виникає жовте забарвлення, що переходить у червоно-оранжеве, а при нагріванні утворюється цегляно-червоний осад і з’являється запах аміаку:

3. У фільтраті підтверджують наявність хлоридів після фільтрації реакційної суміші.
4. Реакція утворення азобарвника червоного кольору, після відновлення нітрогрупи до аміногрупи з подальшим діазотуванням та азосполученням:

5. Експрес-реакція з розчином міді сульфату у лужному середовищі в присутності н-бутанолу – спиртовий шар забарвлюється в синьо-фіолетовий колір внаслідок утворення комплексної солі:

Кількісне визначення:
1. Нітритометрія після попереднього відновлення нітрогрупи до аміногрупи цинковим пилом у кислому середовищі, s = 1:

2. Метод рідинної хроматографії.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 2738; Нарушение авторских прав?; Мы поможем в написании вашей работы!