
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ізопроцеси в газах
|
|
|
|
При сталій масі газу добуток об’єму на тиск, поділений на абсолютну температуру газу, є величина, однакова для всіх станів цієї маси газу.
Газові закони
Газовий закон, який виражає залежність між всіма трьома параметрами газу, називається об’єднаним газовим законом.
Зв’язок між тиском, об’ємом і температурою певної маси газу встановлюють зі співвідношення:
p=n0kT
Оскільки n0 – це кількість молекул газу в одиниці об’єму газу, то
n0 = N / V,
де N – це загальна кількість молекул, V – об’єм газу. Тоді отримаємо:
p = (N / V)kT, або pV / T = Nk.
Так як при сталій масі газу N залишається незмінним, то Nk – стала величина, тобто:
pV / T = const.
Оскільки значення p, V і T відносяться до одного і того ж стану газу, то:
Отже, якщо числові значення параметрів на початку процесу, що відбувається з певною масою газу, позначити через p1,V1 та T1, а їх значення в кінці процесу відповідно через p2,V2 та T2, то
p1V1/T1 = p2V2/T2
Процеси при яких змінюється лише два з трьох параметрів газу називаються ізопроцесами.
Розглянемо такі ізопроцеси.
1. Ізотермічний процес (m = const, m = const, T = const).
Якщо до ізотермічного процесу застосувати рівняння стану у вигляді (3.1.16), то з урахуванням сталості температури T 1 = T 2 воно набуде вигляду
p 1 V 1 = p 2 V 2, pV = const, (3.1.17)
і тому закон Бойля - Маріотта можна сформулювати так: для деякої маси газу добуток тиску газу на об'єм за T = const є сталою величиною.
Цей закон справедливий для будь-яких газів, які можна вважати ідеальними, а також для їх сумішей.
Графічно залежність тиску газу від об'єму при умові T = const можна зобразити у вигляді кривої - ізотерми в координатах p, V і прямих ліній в координатах p, T та V, T (рис.3.1.13 а, б, в).
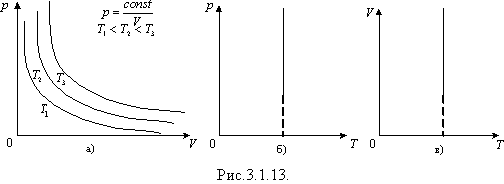
Ізотермічним можна вважати процес стиснення повітря компресором, або розширення під поршнем насоса газу внаслідок відкачування його з посудини.
2. Ізобарний процес (m = const, m = const, T = const).
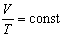 - закон Гей-Люссака,
- закон Гей-Люссака,
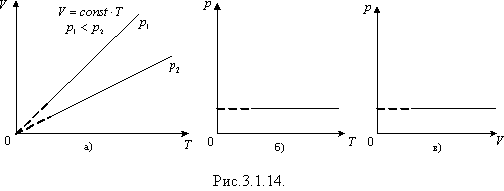
де V = const· T (y = ax).
Графік залежності об'єму від температури за сталого тиску є прямою лінією, яку називають ізобарою. На рис.3.1.14 а зображено дві ізобари в координатах V, T за різних значень тиску p 1 і p 2, причому p 1< p 2. На рис.3.1.14 б, в наведено графіки ізобарного процесу в координатах p, T, p, V.
3. Ізохорний процес (m = const, m = const, T = const).
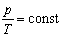 ; p = const· T (y = ax).
; p = const· T (y = ax).
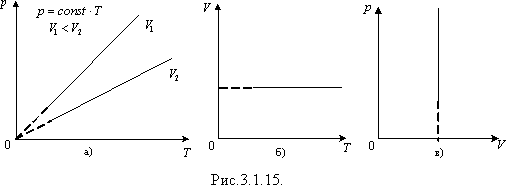
Графіком залежності тиску від температури за сталого об'єму є пряма лінія, яку називають ізохорою. На рис. 3.1.15 а в координатах p, T зображено дві ізохори за різних значень об'єму V 1 і V 2, причому V 1< V 2. На рис. 3.1.15 б, в наведено графіки процесу в координатах V, T і p, V.
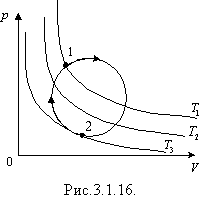
Газові закони і їх графічні ілюстрації дозволяють вивчати довільні термодинамічні процеси з ідеальним газом, наприклад, як встановити нагрівається чи охолоджується газ під час переходу з стану 1 у стан 2 (рис.3.1.16). Для того, щоб це визначити, проводять декілька ізотерм. Газ охолоджується, бо ізотерма T 3 знаходиться нижче ізотерми T 1.
Гази мають низку властивостей, завдяки яким вони незамінні в багатьох технічних установках.
Газ подібний до пружини, яка завжди стиснута. Тиск газу можна змінювати, змінюючи його об'єм або температуру. Крім того, тиск газу залежить від його маси. Збільшуючи масу газу в будь-якому замкненому об'ємі, можна підвищити тиск. Так роблять, накачуючи повітрям автомобільну шину або футбольний м'яч.
Гази порівняно з рідинами і твердими тілами легко стискуються. Велика стисливість газів дає змогу запасати їх у великих кількостях у балонах, зручних для зберігання. Стиснутий природний газ транспортують по трубах на відстані в тисячі кілометрів. Тиск і об'єм газів значно збільшуються з підвищенням температури.
Велика стисливість і легкість, можливість регулювання тиску - усе це робить газ одним із найдосконаліших амортизаторів, який застосовують в багатьох пристроях. Газ - робоче тіло теплових двигунів.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1170; Нарушение авторских прав?; Мы поможем в написании вашей работы!